题目内容
【题目】亚硝酸钠是一种重要的化工原料,请回答下列问题:
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式__________________。
I1.实验室模拟下图所示流程制备亚硝酸钠:

已知: ①氧化过程中,控制反应液温度在35~60℃条件下主要发生反应:
C6H12O6+ 12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
②氢氧化钠溶液吸收NO 和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O

(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是_____ ,氧化过程中反应温度不宜高于60℃,原因是______________。
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为________。
(3)装置B用于制备NaNO2,盛裝的试剂除NaOH(aq)外,还可以是_____ (填字母)。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3( aq )
Ⅲ.测定产品纯度:
[实验步骤] ①准确称量ag 产品配成200mL溶液
②从步骤①配制的溶液中移取20.00mL 加入锥形瓶中
③用c mol/L酸性KMnO4溶液滴定至终点
④重复以上操作3 次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为____________。
(2)产品中NaNO2 的纯度为______________。
【答案】 2FeO42-+3NO2-+5H2O=2Fe(OH)3↓+3NO3-+4OH- 催化纤维素水解 硝酸受热易分解 3:1 B 5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O ![]()
【解析】I. 高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀Fe(OH)3,反应的离子方程式为:2FeO42-+3NO2-+5H2O=2Fe(OH)3↓+3NO3-+4OH-;
II. (1)木屑的主要成分是纤维素[(C6H10O5)n],加H2SO4的目的是催化纤维素水解;温度过高,HNO3会发生分解,使NaNO2产率降低;
(2) 根据方程式2NaOH+NO+NO2=2NaNO2+H2O、2NaOH+2NO2=NaNO2+NaNO2+H2O,可知反应中还有硝酸钠生成,因此另一种阴离子是硝酸根离子,生成1mol硝酸钠同时还有1mol亚硝酸钠生成,根据C6H12O6+ 12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O可知参与反应2NaOH+NO+NO2=2NaNO2+H2O的NO和NO2均是3mol,另外6mol NO2与氢氧化钠溶液反应,所以亚硝酸根与硝酸根的物质的量之比为(6+3):3=3:1;(3) 用NaOH吸收的原理是:2NaOH+NO+NO2=2NaNO2+H2O,即在碱性溶液中NO2和NO发生归中反应,还可以是选用Na2CO3溶液,答案选B;Ⅲ. (1)锥形瓶中亚硝酸盐被氧化为硝酸盐,发生反应的离子方程式为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
(2)设产品中NaNO2的纯度为x,根据反应5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O,则:
5NaNO2-~~~~~~~~~2MnO4-
5×69 2
axg cmol/L×VmL×10-3mL/L×![]()
2axg=5×69×cmol/L×VmL×10-3mL/L×![]() ,解得x=
,解得x=![]() 。
。

【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是____和____(填分子式)。
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=_______________kJ·mol–1
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的微粒是____。
②在30 ℃、pH=4.0条件下,O3的分解速率为_____mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为_____(填字母)。
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
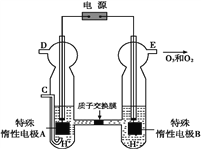
①图中阴极为____(填“A”或“B”),其电极反应式为_________________________。
②若C处通入O2,则A极的电极反应式为________,右室pH变化___________(填升高、降低、不变)
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是 , 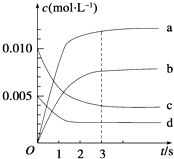
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v= .
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)