题目内容
【题目】工业生产硫酸的黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)是工业三废之一,其综合利用是一条变废为宝的重要途径。
I.以黄铁矿烧渣为原料制备颜料铁红(Fe2O3)和回收(NH4)2SO4的生产工艺流程如下图:
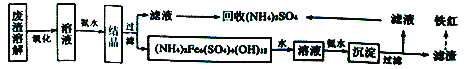
请回答下列问题:
(1)能提高“废渣溶解”速率的措施有______(写出一条即可),“氧化”的目的是______________。 (2)(NH4)2Fe6(SO4)4(OH)12中Fe的化合价是__________________。
(3)该工艺流程图中,第二次加入氨水后,反应的离子方程式为________________________。
II.下图是以黄铁矿烧渣为原料制备颜料铁红的另外一种生产工艺流程:
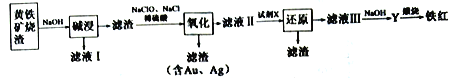
(4)在滤液I中加入廉价的熟石灰,反应的化学方程式是___________________。
(5)“氧化”反应较多,其中FeS 可以看做被水溶液中Cl2氧化,氧化后的溶液中滴加BaCl2有不溶解于盐酸的白色沉淀生成,则水溶液中FeS 与Cl2 反应的离子方程式为________________。
(6)试剂X 为过量铁粉,其作用是________________________________。
【答案】 将废渣粉碎、提高溶解温度等 将+2 价铁氧化为+3价铁 +3 3NH3·H2O+Fe3+=Fe(OH)3↓+3NH4+ Na2SiO3+Ca(OH)2=2NaOH+CaSiO3↓ 2FeS+9Cl2+8H2O=2Fe3++2SO42-+18C1—+16H+ 主要目的是把Cu2+还原为Cu,还可以还原Fe3+ 为Fe2+
【解析】I.黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)用硫酸溶解后的溶液中含有硫酸铁和硫酸亚铁,将+2价铁氧化为+3价铁氧化后,加入氨水,生成碱式硫酸铁铵沉淀,碱式硫酸铁铵沉淀用水溶解后的溶液中加入氨水,生成氢氧化铁沉淀,过滤后灼烧得到氧化铁;2次过滤后的滤液中主要含有硫酸铵,可以回收得到硫酸铵晶体。
(1)能提高“废渣溶解”速率的措施可以有将废渣粉碎、提高溶解温度、搅拌等,黄铁矿烧渣的主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等,溶解后 “氧化”过程中可以将+2价铁氧化为+3价铁,故答案为:将废渣粉碎、提高溶解温度等;将+2价铁氧化为+3价铁;
(2)(NH4)2Fe6(SO4)4(OH)12中NH4+、SO42-、OH-整体显+1价、-2价、-1价,根据正负化合价的代数和为0,Fe的化合价是+3价,故答案为:+3;
(3)第二次加入氨水后,反应的离子方程式为3NH3·H2O+Fe3+=Fe(OH)3↓+3NH4+,故答案为:3NH3·H2O+Fe3+=Fe(OH)3↓+3NH4+;
II.根据流程图,黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)用氢氧化钠溶解,生成的溶液中含有硅酸钠,滤渣中含有Fe2O3及少量的FeS、Cu、Au、Ag等,滤渣用硫酸溶解,同时用次氯酸钠氧化生成的亚铁离子,滤渣中含有Au、Ag等,滤液中含有铁离子和铜离子,需要除去铜离子,为了不引入新杂质,需要加入铁粉将铜离子还原,得到的滤液为硫酸亚铁,加入氢氧化钠生成氢氧化亚铁,被空气中的氧气氧化生成氢氧化铁,灼烧得到氧化铁。
(4) 滤液I中含有硅酸钠,加入廉价的熟石灰,发生复分解反应,生成硅酸钙沉淀,反应的化学方程式为Na2SiO3+Ca(OH)2=2NaOH+CaSiO3↓,故答案为:Na2SiO3+Ca(OH)2 =2NaOH+CaSiO3↓;
(5)“氧化”反应较多,其中FeS可以看做被水溶液中Cl2氧化,氧化后的溶液中滴加BaCl2有不溶解于盐酸的白色沉淀生成,说明生成了硫酸根离子,则水溶液中FeS与Cl2反应的离子方程式为2FeS+9Cl2+8H2O=2Fe3++2SO42-+18C1-+16H+,故答案为:2FeS+9Cl2+8H2O=2Fe3++2SO42-+18C1-+16H+;
(6)试剂X为过量铁粉,目的是把Cu2+还原为Cu,还可以还原Fe3+为Fe2+,故答案为:把Cu2+还原为Cu,还可以还原Fe3+为Fe2+。




