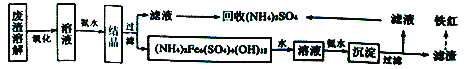
题目内容
【题目】实验室配制 500mL 0.2mol/L 的 NaOH溶液,在下图所示仪器中,配制上述溶液肯定不需要的是____(填序号),除图中已有仪器外, 配制上述溶液还需要的玻璃仪器是____。

具体过程如下:
①计算需要称量 NaOH 固体的质量_____;
②用少量蒸馏水洗涤烧杯内壁 2~3 次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
③用托盘天平称量 NaOH 固体;
④将 NaOH 溶液沿玻璃棒注入_____中;
⑤将称好的 NaOH 固体放入烧杯中,用适量蒸馏水溶解,并____________;
⑥盖好瓶塞,反复上下颠倒,摇匀;
⑦将蒸馏水注入容量瓶,液面离刻度线下_____cm 时,改用_______滴加蒸馏水至液面于刻度线相切;
试回答下列问题:
(1)填写上述过程中的空白;
(2)上述过程的正确顺序为___________(填步骤序号);
(3)使用容量瓶前必须进行的一步操作是____________;
(4)经精确测量,最后所得溶液物质的量浓度为 0.192mol/L,原因可能是____________。
A、使用滤纸称量 NaOH 固体;
B、未冷却直接转移至容量瓶,立即配好;
C、容量瓶中原来有少量蒸馏水;
D、称量时所用的砝码生锈;
E、溶解 NaOH 后的烧杯未经多次洗涤;
F、定容时俯视刻度。
【答案】C玻璃棒、烧杯4g500mL容量瓶冷却到室温1~2胶头滴管①③⑤④②⑦⑥检查是否漏水AE
【解析】
(1)配制一定物质的量浓度的溶液所必需的仪器有:一定规格的容量瓶,托盘天平、烧杯、玻璃棒、胶头滴管,量筒等,肯定用不到分液漏斗;根据图示,还缺少的玻璃仪器有玻璃棒、烧杯;500mL 0.2mol/L 的 NaOH溶液中含有氢氧化钠的物质的量为0.5L×0.2mol/L=0.1mol,质量为0.1mol×40g/mol=4g;转移时,将 NaOH 溶液沿玻璃棒注入500mL容量瓶中;称量好的氢氧化钠需要在烧杯中溶解,并冷却到室温;定容时,将蒸馏水注入容量瓶,液面离刻度线下1~2cm 时,改用胶头滴管滴加蒸馏水至液面于刻度线相切;故答案为:C;玻璃棒、烧杯;4g;500mL容量瓶;冷却到室温;1~2;胶头滴管;
(2)配制溶液的一般步骤为:计算、称量、溶解、冷却转移、洗涤、定容、摇匀。正确顺序为①③⑤④②⑦⑥,故答案为:①③⑤④②⑦⑥;
(3)容量瓶口部有塞子,使用容量瓶前必须检查容量瓶是否漏水,故答案为:检查是否漏水;
(4)经精确测量,最后所得溶液物质的量浓度为 0.192mol/L,浓度偏低。A、氢氧化钠具有吸水性,使用滤纸称量 NaOH 固体,导致氢氧化钠的质量偏小,浓度偏低,正确;B、未冷却直接转移至容量瓶,导致溶液的体积偏小,浓度偏大,错误;C、容量瓶中原来有少量蒸馏水不影响溶质的量和溶液的体积,对浓度无影响,错误;D、称量时所用的砝码生锈,导致称量的氢氧化钠偏多,浓度偏大,错误;E、溶解 NaOH 后的烧杯未经多次洗涤,导致氢氧化钠的量偏少,浓度偏低,正确;F、定容时俯视刻度,导致溶液的体积偏小,浓度偏大,错误;故选AE。

 名校课堂系列答案
名校课堂系列答案【题目】氢能是一种极具发展潜力的清洁能源。
(1)氢气的制取与储存是氢能源利用领域的研究热点.
已知:①CH4的燃烧热为890KJ·mol-1; ②H2的热值为50.2kJ·g-1
则甲烷部分氧化生成CO2和H2的热化学方程式为___________________________________;该反应自发进行的条件是___________。
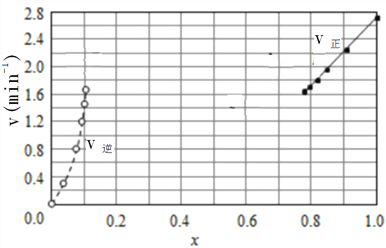
(2)Bodensteins研究了如下反应:2HI(g)![]() H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1.00 | 0.910 | 0.850 | 0.815 | 0.795 | 0.784 |
X(HI) | 0.00 | 0.600 | 0.730 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00min-1,在t=20min时,v逆=__________min-1(保留三位有效数字)
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。______________
(3)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________。