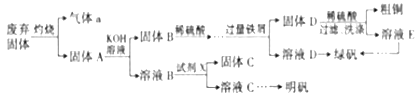
题目内容
【题目】反应CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g) △H<0,达到平衡时,下列说法正确的是
CO(NH2)2(s)+H2O(g) △H<0,达到平衡时,下列说法正确的是
A. 加入催化剂,平衡常数不变
B. 减小容器体积,正反应速率增大、逆反应速率减小
C. 增大CO(NH2)2的量, CO2的转化率减小
D. 降低温度,平衡向逆反应方向移动
【答案】A
【解析】A.催化剂改变化学反应速率,不改变化学平衡,加入催化剂,平衡常数不变,故A正确;B.减小容器体积相当于增大压强,反应速率增大,正逆反应速率都增大,故B错误;C.固体对化学平衡无影响,增大CO(NH2)2的量,CO2的转化率不变,故C错误;D.依据化学平衡移动原理分析,反应是放热反应,降低温度,平衡正向进行,故D错误;故选A。

练习册系列答案
相关题目