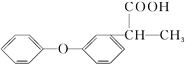
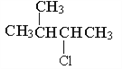
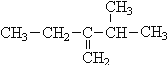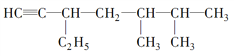题目内容
【题目】在150℃时碳酸铵可以受热完全分解,(NH4)2CO3 ![]() 2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
A. 96倍 B. 48倍 C. 12倍 D. 32倍
【答案】C
【解析】
由150℃时(NH4)2CO3分解的方程式和质量守恒定律确定气态混合物的质量和气态混合物物质的量,进一步求出气态混合物的平均摩尔质量,再利用“在相同条件下气体的密度之比等于气体的摩尔质量之比”计算。
(NH4)2CO3分解的化学方程式为(NH4)2CO3![]() 2NH3↑+CO2↑+H2O↑,1mol(NH4)2CO3完全分解生成2molNH3、1molCO2和1molH2O(g),1mol(NH4)2CO3的质量为96g,根据质量守恒定律,气态混合物的质量为96g,气态混合物的平均摩尔质量为96g÷(2mol+1mol+1mol)=24g/mol;在相同条件下气体的密度之比等于气体的摩尔质量之比,气态混合物的密度是H2密度的
2NH3↑+CO2↑+H2O↑,1mol(NH4)2CO3完全分解生成2molNH3、1molCO2和1molH2O(g),1mol(NH4)2CO3的质量为96g,根据质量守恒定律,气态混合物的质量为96g,气态混合物的平均摩尔质量为96g÷(2mol+1mol+1mol)=24g/mol;在相同条件下气体的密度之比等于气体的摩尔质量之比,气态混合物的密度是H2密度的![]() =12倍,答案选C。
=12倍,答案选C。

练习册系列答案
相关题目