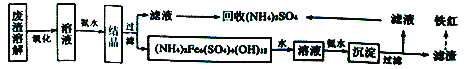
题目内容
【题目】某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:

(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+
萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是__________________________。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为__________,应调节pH的范围为_________________。
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5 时,Mg(OH)2开始沉淀
(5)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为___________________,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________。

【答案】 升高温度、搅拌、提高硫酸浓度等 MgCO3+2H+=Mg2++H2O+CO2↑ MgSiO3+2H+=Mg2++H2SiO3 将Fe2+氧化为Fe3+ ,便于除去 KSCN 溶液 MgO、Mg(OH)2、MgCO3或Mg2(OH)2 CO3 5.0<pH<8.5 293K~313K(313K以下也可) 5MgCO3·3H2O =Mg5 (OH)2 (CO3)4· 4H2O+CO2↑+10H2O
【解析】试题分析:本题通过“用工业废料制备MgCO3·3H2O”的研究,主要考查外界条件对化学反应速率的影响、离子反应方程式、化学方程式、Fe2+的还原性、Fe3+检验、溶度积的计算等基础知识,考查考生对流程图的分析能力、溶度积的认识和理解、X射线衍射谱图的分析能力和化学知识的综合运用能力。
解析:(1)废渣中的MgCO3、MgSiO3、Fe、Al分别与H2SO4反应生成MgSO4、FeSO4、Al2(SO4)3、H2SiO3等,根据影响化学反应速率的因素相关知识,为了提高酸溶速率,可以采取粉碎固体、适当升高溶液温度、适当提高硫酸浓度、搅拌等措施。正确答案:粉碎固体(或者适当升高溶液温度、适当提高硫酸浓度等)、MgCO3+2H+=Mg2++H2O+CO2↑及MgSiO3+2H+=Mg2++H2SiO3。(2)酸溶后过滤除去H2SiO3,溶液中加入30%的H2O2可以将Fe2+氧化成Fe3+,这样便可以在下一步用有机溶剂通过萃取除去Fe3+。正确答案:将Fe2+氧化为Fe3+ ,便于萃取除去。(3)萃取完成后,检验Fe3+可以取萃取后的水溶液,加入KSCN溶液,混合溶液不变成红色说明不含Fe3+。正确答案:KSCN溶液。(4)萃取分液后还需要除去Al3+,可以加入MgO(或者Mg(OH)2、或MgCO3)消耗H+使溶液酸性减弱进而生成Al(OH)3沉淀。根据Al(OH)3的溶度积常数, ![]() ,则c(OH-)=1×10-9mol/L,c(H+)=1×10-5mol/L,pH=5。既当溶液pH=5时,Al(OH)3开始沉淀,而pH=8.5时,Mg(OH)2开始沉淀,因此为了除去Al3+并确保Mg2+不损失,需控制溶液pH为5~8.5。正确答案:MgO(或Mg(OH)2、或MgCO3、或Mg2(OH)2 CO3)、5.0~8.5(或5.0<pH<8.5)。(5)从图中可以得知,当温度升高至313K以上, MgCO3·3H2O就有可能发生反应,323K既更高温度下,MgCO3·3H2O转变成Mg5 (OH)2 (CO3)4· 4H2O,影响产品质量。所以温度应当控制在313K以下。323K时已知的变化为MgCO3·3H2O→Mg5 (OH)2 (CO3)4· 4H2O,同时生成的产物只可能是CO2、H2O,配平得5MgCO3·3H2O =Mg5 (OH)2 (CO3)4· 4H2O+CO2↑+10H2O。正确答案:313K以下(或293K~313K)、5MgCO3·3H2O =Mg5 (OH)2 (CO3)4· 4H2O+CO2↑+10H2O。
,则c(OH-)=1×10-9mol/L,c(H+)=1×10-5mol/L,pH=5。既当溶液pH=5时,Al(OH)3开始沉淀,而pH=8.5时,Mg(OH)2开始沉淀,因此为了除去Al3+并确保Mg2+不损失,需控制溶液pH为5~8.5。正确答案:MgO(或Mg(OH)2、或MgCO3、或Mg2(OH)2 CO3)、5.0~8.5(或5.0<pH<8.5)。(5)从图中可以得知,当温度升高至313K以上, MgCO3·3H2O就有可能发生反应,323K既更高温度下,MgCO3·3H2O转变成Mg5 (OH)2 (CO3)4· 4H2O,影响产品质量。所以温度应当控制在313K以下。323K时已知的变化为MgCO3·3H2O→Mg5 (OH)2 (CO3)4· 4H2O,同时生成的产物只可能是CO2、H2O,配平得5MgCO3·3H2O =Mg5 (OH)2 (CO3)4· 4H2O+CO2↑+10H2O。正确答案:313K以下(或293K~313K)、5MgCO3·3H2O =Mg5 (OH)2 (CO3)4· 4H2O+CO2↑+10H2O。

【题目】氢能是一种极具发展潜力的清洁能源。
(1)氢气的制取与储存是氢能源利用领域的研究热点.
已知:①CH4的燃烧热为890KJ·mol-1; ②H2的热值为50.2kJ·g-1
则甲烷部分氧化生成CO2和H2的热化学方程式为___________________________________;该反应自发进行的条件是___________。
(2)Bodensteins研究了如下反应:2HI(g)![]() H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1.00 | 0.910 | 0.850 | 0.815 | 0.795 | 0.784 |
X(HI) | 0.00 | 0.600 | 0.730 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
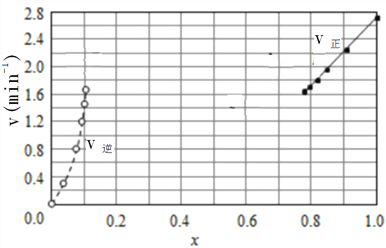
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00min-1,在t=20min时,v逆=__________min-1(保留三位有效数字)
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。______________
(3)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________。