题目内容
19.下列实验装置设计正确、且能达到目的是( )| 编号 | A | B | C | D |
| 实验 方案 | 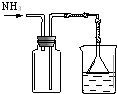 |  | 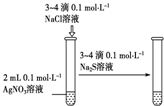 |  置于光亮处 |
| 实验 目的 | 收集氨气及并进行 尾气吸收 | 制取乙炔并验证炔烃 的性质 | 验证AgCl沉淀可转化为 溶解度更小的Ag2S沉淀 | 验证甲烷与氯气发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氨气的密度比空气密度小,极易溶于水;
B.水与碳化钙制备乙炔反应较快,硫酸铜可除去硫化氢,乙炔与溴发生加成反应;
C.硝酸银过量,不能发生沉淀的转化;
D.甲烷与氯气发生取代反应生成HCl,试管中液面上升.
解答 解:A.氨气的密度比空气密度小,极易溶于水,则图中向下排空气法收集及防倒吸的吸收装置均合理,故A正确;
B.水与碳化钙制备乙炔反应较快,硫酸铜可除去硫化氢,乙炔与溴发生加成反应,应利用饱和食盐水代替水,除杂后再检验乙烯,且点燃乙炔应先验纯,故B错误;
C.硝酸银过量,不能发生沉淀的转化,均为沉淀的生成,则不能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀,故C错误;
D.甲烷与氯气发生取代反应生成HCl,试管中液面上升,实验装置可验证甲烷与氯气发生了化学反应,故D正确;
故选AD.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备及收集、性质实验、沉淀的生成和转化等,把握物质的性质、反应原理为解答的关键,侧重元素化合物知识及分析应用能力的综合考查,注意实验装置的作用及实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.在常温下,对于pH=3的醋酸溶液.下列说法正确的是( )
| A. | 在醋酸溶液中,NH4+、Na+、SiO32-、C2O42-能大量共存 | |
| B. | 与Na2S2O3溶液反应的离子方程式:S2O32-+2H+═S↓+SO2↑+H2O | |
| C. | 常温下,加水稀释醋酸,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| D. | 该醋酸溶液中c(CH3COO-)<0.001 mol•L-1 |
10.2014年诺贝尔化学奖获得者Moerner早在1989年就利用吸收光谱在4K温度条件下观察到了单个 并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )
并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )
 并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )
并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )| A. | 4 | B. | 6 | C. | 7 | D. | 11 |
14.下列有关叙述正确的是( )
| A. | 等体积、等pH的盐酸和醋酸与足量的NaOH溶液反应,消耗NaOH的物质的量相同 | |
| B. | 常温下,某物质的水溶液的pH<7,则该物质一定是酸或强酸弱碱盐 | |
| C. | 常温下,pH=12的氨水与pH=2的盐酸等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
4.一定温度下,可逆反应A(气)+3B(气)?2C(气)在一定容积的密闭容器中进行,达到平衡的标志是( )
| A. | 混合气体的密度不再变化 | B. | A、B、C的浓度相等 | ||
| C. | 混合气体的压强不再变化 |
11.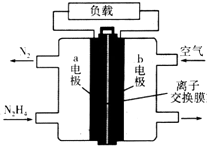 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述不正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述不正确的是( )
 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述不正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述不正确的是( )| A. | a极的反应式:N2H4+4OH--4e-═N2↑+4H2O | |
| B. | 放电时,电子从a极经过负载流向b极 | |
| C. | 该电池持续放电时,离子交换膜需选用阴离子交换膜 | |
| D. | 电路中转移电子3NA时消耗氧气16.8 L |
8.下列区分苯和己烯的试验方法和判断正确的是( )
| A. | 分别点燃,无黑烟生成的是苯 | |
| B. | 分别加入溴水振荡,静置后分层,橙黄色消失的是己烯 | |
| C. | 分别加入溴的CCl4,静置后分层,上下两层均为无色的是已烯 | |
| D. | 分别加入酸性KMnO4溶液振荡,紫色消失的是己烯 |
9.10mL浓度为1mol•L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( )
| A. | K2SO4 | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
