题目内容
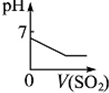
9.在常温下,对于pH=3的醋酸溶液.下列说法正确的是( )| A. | 在醋酸溶液中,NH4+、Na+、SiO32-、C2O42-能大量共存 | |
| B. | 与Na2S2O3溶液反应的离子方程式:S2O32-+2H+═S↓+SO2↑+H2O | |
| C. | 常温下,加水稀释醋酸,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| D. | 该醋酸溶液中c(CH3COO-)<0.001 mol•L-1 |
分析 A、硅酸与草酸的酸性均弱于醋酸,pH=3的溶液为酸性溶液,弱酸根离子不能与氢离子大量共存;
B、醋酸为弱酸,不能完全电离,醋酸不能拆;
C、加水稀释醋酸,氢离子浓度减小,氢氧根浓度增大;
D、醋酸为弱酸,pH=3,氢离子浓度=0.001mol/L,据此解答即可.
解答 解:A、硅酸与草酸的酸性均弱于醋酸,pH=3的溶液为酸性溶液,SiO32-、C2O42-不能大量共存,故A错误;
B、醋酸为弱酸,不能完全电离,醋酸不能拆,正确离子方程式为:S2O32-+2CH3COOH═S↓+SO2↑+H2O+2CH3COO-,故B错误;
C、醋酸的电离常数K=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}=\frac{c(C{H}_{3}CO{O}^{-})×\frac{{K}_{W}}{c(O{H}^{-})}}{c(C{H}_{3}COOH)}$=Kw×$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$,温度不变,K值不变,水的离子积常数Kw不变,故$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变,故C错误;
D、pH=3的醋酸中c(H+)=0.001mol/L,氢离子来源于醋酸的电离和水的电离两部分,由醋酸电离出的氢离子浓度等于醋酸根的浓度,故(CH3COO-)<c(H+)=0.001 mol•L-1,故D正确,
故选D.
点评 本题主要考查的是醋酸的性质以及弱电解质的电离,容易出错的是C选项,注意电离常数只与温度有关是关键,难度不大.

练习册系列答案
相关题目
2.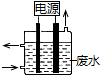 用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式:2H2O+2e-═H2↑+2OH- | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O |
17.最近媒体报道了一些化学物质,如:爆炸力极强的N5、比黄金还贵的18O、太空中的甲醇气团等.下列说法中正确的是( )
| A. | 18O2和16O2是两种不同的原子 | B. | 甲醇(CH3OH)属于离子化合物 | ||
| C. | N5和N2是氮元素的两种同位素 | D. | 由N5变成N2是化学变化 |
4.化学与生产生活密切相关,下列说法不正确的是( )
| A. | 小苏打可用作糕点的膨化剂 | |
| B. | 二氧化硫可用作食品的漂白剂 | |
| C. | PX(对二甲苯)是生成塑料、聚酯纤维和薄膜的主要原料 | |
| D. | PM2.5指数是雾霾天气监测中的重要指标 |
19.下列实验装置设计正确、且能达到目的是( )
| 编号 | A | B | C | D |
| 实验 方案 | 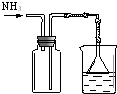 | 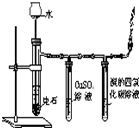 | 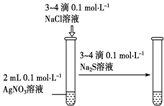 | 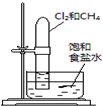 置于光亮处 |
| 实验 目的 | 收集氨气及并进行 尾气吸收 | 制取乙炔并验证炔烃 的性质 | 验证AgCl沉淀可转化为 溶解度更小的Ag2S沉淀 | 验证甲烷与氯气发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
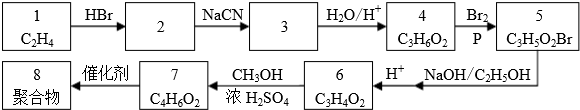
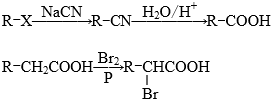
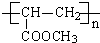 .
.
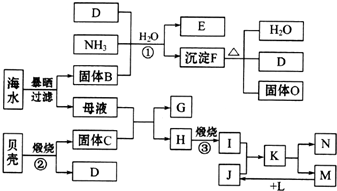
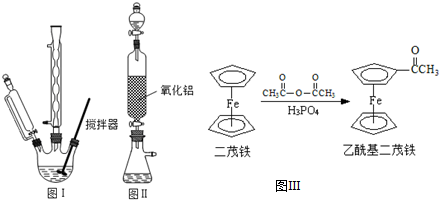
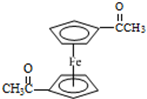 ),可以使用的仪器分析方法是质谱法或核磁共振氢谱.
),可以使用的仪器分析方法是质谱法或核磁共振氢谱.