题目内容
10.2014年诺贝尔化学奖获得者Moerner早在1989年就利用吸收光谱在4K温度条件下观察到了单个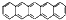 并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )
并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )| A. | 4 | B. | 6 | C. | 7 | D. | 11 |
分析 根据并五苯的结构特点, 计算出等效氢原子数目.
计算出等效氢原子数目.
解答 解:根据并五苯的结构简式可知,如图 ,其分子中含有4种化学环境的H,所以其一氯代物有4种;
,其分子中含有4种化学环境的H,所以其一氯代物有4种;
故选A.
点评 本题考查了同分异构体数目的求算,题目难度中等,注意掌握同分异构体的概念,明确同分异构体数目的求算方法.

练习册系列答案
相关题目
5.下列结构简式所代表的有机物有( )种.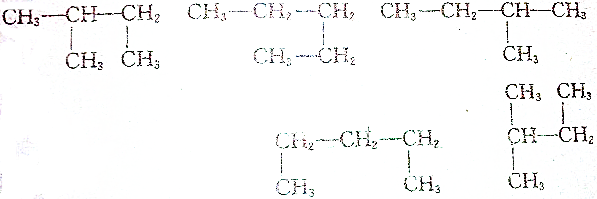
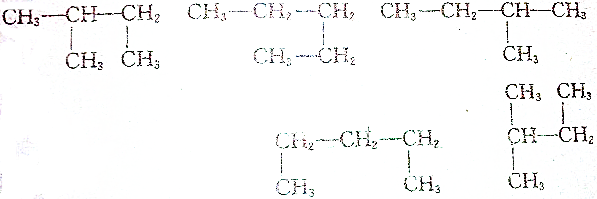
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
15.下列反应的离子方程式正确的是( )
| A. | 少量二氧化硫气体通入到漂白粉溶液中;Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| B. | 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 少量的钠投入足量的水中:2Na+2H2O=2Na++2OH-+H2↑ | |
| D. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
19.下列实验装置设计正确、且能达到目的是( )
| 编号 | A | B | C | D |
| 实验 方案 | 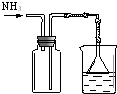 | 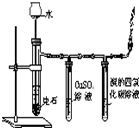 | 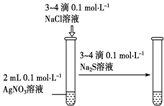 | 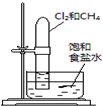 置于光亮处 |
| 实验 目的 | 收集氨气及并进行 尾气吸收 | 制取乙炔并验证炔烃 的性质 | 验证AgCl沉淀可转化为 溶解度更小的Ag2S沉淀 | 验证甲烷与氯气发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
20.关于HOOC-CH═CH-CH2OH,下列说法不正确的是( )
| A. | 分子式为C4H6O3,每摩尔该物质充分燃烧需消耗4mol O2 | |
| B. | 能发生取代、加成、氧化、加聚、中和等反应 | |
| C. | 分别与足量Na、NaOH、Na2CO3反应,生成物均为NaOOC-CH═CH-CH2OH | |
| D. | 该分子含有两种官能团 |
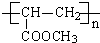 .
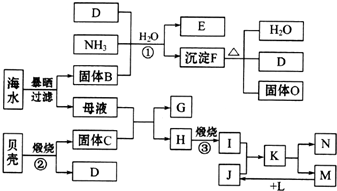
.
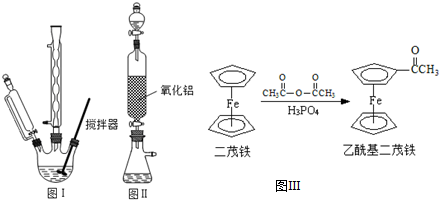
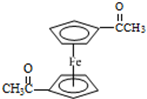 ),可以使用的仪器分析方法是质谱法或核磁共振氢谱.
),可以使用的仪器分析方法是质谱法或核磁共振氢谱.