题目内容
化学计量在化学中占有重要地位,请回答下列问题:
(1)标准状况下6.72 L NH3分子中所含原子数与 mL H2O所含原子数相等。
(2)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 。
(3)把V L含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为________。(用a、b、V表示)
(1) 7.2 (2) 106 g/moL (3)  moL/L
moL/L
解析试题分析:(1)根据n=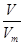 可知,在标准状况下6.72 L NH3的物质的量=6.72L÷22.4L/mol=0.3mol
可知,在标准状况下6.72 L NH3的物质的量=6.72L÷22.4L/mol=0.3mol
分子中含有原子的物质的量=0.3mol×4=1.2mol
由于水分子中含有3个原子,所以如果水分子中原子的物质的量是1.2mol
则水的物质的量=1.2mol÷3=0.4mol
其质量=0.4mol×18g/mol=7.2g
所以水的体积是7.2ml
(2)16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D
则根据质量守恒定律可知,生成C的质量=16g+20g-31.76g=4.24g
所以C的摩尔质量=4.24g÷0.04mol=106g/mol
(3)一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2,则根据方程式可知
Mg2++2OH-=Mg(OH)2↓
1mol 2mol
0.5amol amol
另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀为BaSO4,则根据方程式可知
Ba2++SO42-=BaSO4↓
1mol 1mol
bmol bmol
因此原溶液中Mg2+和SO42-的物质的量分别是amol和2bmol
则根据溶液的电中性可知,原混合溶液中钾离子的物质的量=4bmol-2amol
所以原混合溶液中钾离子的物质的量浓度=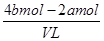 =
= mol/L
mol/L
考点:考查物质的量、气体摩尔体积、摩尔质量以及物质的量浓度的有关计算

用Na2CO3固体配制1mol/L的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③酒精灯;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50mL烧杯;应选用的仪器(填编号) 。
(2)应称取Na2CO3的质量为 g;若称量时砝码和物品放反了,则实际称量的Na2CO3的质量为 g 。
(3)下列操作,会引起所配溶液浓度偏高的是( )
| A.称取的Na2CO3固体中有杂质 |
| B.溶解Na2CO3固体时,因搅拌剧烈使烧杯中的溶液溅出少量 |
| C.没有洗涤烧杯及玻璃棒 |
| D.定容时发现液面高于刻度线,用胶头滴管吸出多余的溶剂 |
F、定容时俯视刻度线
G、定容摇匀后,发现液面低于刻度线,再加至刻度线
(4)取所配Na2CO3溶液20ml,向其中滴加足量的稀盐酸,可得到标况下的气体 L,将得到的气体全部通入足量的澄清石灰水,充分反应后,将沉淀过滤,洗涤,干燥,最后可得固体 g。

