题目内容
1.根据下列各反应现象所归纳的元素性质不正确的是( )| A. | 将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出,不能说明钠的金属性比铜弱 | |
| B. | 用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝,说明氯元素的非金属性比碘元素强 | |
| C. | 把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出,说明Cl的非金属性比S强 | |
| D. | 将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol,说明这三种金属的活泼性为:Al>Mg>Na |
分析 A.金属钠性质活泼,投入到硫酸铜溶液中,先和水反应,不能置换出铜;
B.氯气与碘化钾发生置换反应生成单质碘;
C.氯气具有较强的氧化性,与硫化氢气体反应生成单质硫;
D.金属的活泼性与失去电子的难易有关,与失去电子的多少无关.
解答 解:A.金属钠性质活泼,投入到硫酸铜溶液中,先和水反应生成NaOH和氢气,进而生成氢氧化铜,不能置换出铜,所以不同用该反应说明钠的金属性比铜弱,故A正确;
B.氯元素的非金属性比碘元素强,则氯气的氧化性比碘强,氯气与碘化钾发生置换反应生成单质碘,故B正确;
C.Cl的非金属性比S强,氯气具有较强的氧化性,与硫化氢气体反应生成单质硫,故C正确;
D.金属的活泼性与失去电子的难易有关,与失去电子的多少无关,不能用电子的多少比较金属性强弱,故D错误.故选D.
点评 本题考查金属性、非金属性的比较,题目难度不大,注意比较的角度是否合理.把握比较方法.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
6.据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:HC≡C-C≡C-C≡C-C≡C-C≡N.对该物质判断正确的是( )
| A. | 该分子中不含极性共价键 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 不能发生加成反应 | D. | 可由乙炔和含氮化合物加聚制得 |
9.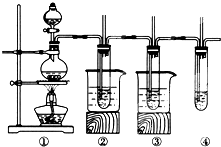 在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.
在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.
(1)③试管中制取次氯酸钠的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O
(2)实验中可观察到④试管中溶液的颜色发生如下变化,填写表格.
(3)此实验有一个明显的不足之处,应如何改进?④后增加一个盛有氢氧化钠溶液的烧杯用于吸收多余的氯气.
 在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.
在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.(1)③试管中制取次氯酸钠的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O
(2)实验中可观察到④试管中溶液的颜色发生如下变化,填写表格.
| 实验现象 | 原因 |
| 溶液最初从紫色变为红色 | 氯气与水反应生成的HCl使石蕊试液变红 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 |
| 最后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
6.在标准状况下,10mL某气态烃在80mL O2中充分燃烧后,恢复到标准状况,所得气体的体积为60mL,该烃可能是( )
| A. | C3H8 | B. | C3H6 | C. | C3H4 | D. | C4H10 |
13.A、B、C、D、E为短周期元素,在周期表中所处的位置如图所示.A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
(1)写出三种元素名称A氮、B硫、C氟.
(2)B元素位于元素周期表中第三周期,ⅥA族.
(3)比较B、D、E三种元素的最高价氧化物的水化物酸(碱)性最强的是(用化学式表示)HClO4;
(4)C原子结构示意图为 .
.
| A | C | |
| D | B | E |
(2)B元素位于元素周期表中第三周期,ⅥA族.
(3)比较B、D、E三种元素的最高价氧化物的水化物酸(碱)性最强的是(用化学式表示)HClO4;
(4)C原子结构示意图为
 .
.
10.具有下列价电子数的原子,最难形成离子的是( )
| A. | L层6个 | B. | L层4个 | C. | M层2个 | D. | M层7个 |
 .
.