题目内容
18.60mL 2mol/L Na0H溶液与40mL 3mol/L Na0H溶液相混合(设混合后的体积变化忽略不计),求溶质的物质的量浓度.分析 根据n=cV计算混合后NaOH的总物质的量,计算总体积,可计算浓度.
解答 解:60mL 2mol Na0H溶液中NaOH的物质的量为0.06L×2mol/L=0.12mol,
40mL 3mol Na0H溶液中NaOH的物质的量为0.04L×3mol/L=0.12mol,
总物质的量为0.24mol,总体积为100mL,
浓度为$\frac{0.24mol}{0.1L}$=2.4mol/L.
答:溶质的物质的量浓度2.4mol/L.
点评 本题考查物质的量浓度的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式,难度不大.

练习册系列答案
相关题目
9.下列实验过程始终无明显现象的是( )
| A. | NO2气体通入FeSO4溶液中 | B. | CO2通入Ba(NO3)2溶液中 | ||
| C. | SO2气体通入Ca(NO3)2溶液中 | D. | CO2气体通入Ca(ClO)2溶液中 |
6.据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:HC≡C-C≡C-C≡C-C≡C-C≡N.对该物质判断正确的是( )
| A. | 该分子中不含极性共价键 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 不能发生加成反应 | D. | 可由乙炔和含氮化合物加聚制得 |
3.2mol Cl2和2mol CO2相比较,下列叙述中正确的是( )
| A. | 分子数相等 | B. | 原子数相等 | C. | 质子数相等 | D. | 质量相等 |
13.A、B、C、D、E为短周期元素,在周期表中所处的位置如图所示.A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
(1)写出三种元素名称A氮、B硫、C氟.
(2)B元素位于元素周期表中第三周期,ⅥA族.
(3)比较B、D、E三种元素的最高价氧化物的水化物酸(碱)性最强的是(用化学式表示)HClO4;
(4)C原子结构示意图为 .
.
| A | C | |
| D | B | E |
(2)B元素位于元素周期表中第三周期,ⅥA族.
(3)比较B、D、E三种元素的最高价氧化物的水化物酸(碱)性最强的是(用化学式表示)HClO4;
(4)C原子结构示意图为
 .
. 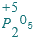 .
.