题目内容
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是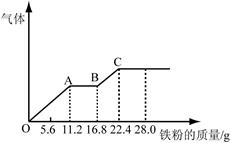
| A.混合酸中HNO3物质的量浓度为2 mol·L-1 |
| B.原混合酸中H2SO4物质的量为0.4 mol |
| C.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| D.第二份溶液中最终溶质为FeSO4 |
B
解析试题分析:A、根据图像可知OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,故原混合液中n(NO3-)=2n(Fe)=2×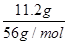 =0.4mol,因此混合酸中HNO3物质的量浓度为0.4mol÷0.2L=0.2mol/L,故A正确;B、第二份反应消耗22.4g铁,物质的量为22.4g÷56g/mol=0.4mol。所有的铁元素都在硫酸亚铁中,根据硫酸根守恒可知,每份含硫酸0.4mol,所原混合酸中H2SO4物质的量为0.4mol×2=0.8mol,B不正确;C、由图象可知,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O。由于铁过量,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故C正确;D、酸全部被还原,铁元素全部以硫酸亚铁的形式存在于溶液中,所以溶液中最终溶质为FeSO4,故D正确,答案选B。
=0.4mol,因此混合酸中HNO3物质的量浓度为0.4mol÷0.2L=0.2mol/L,故A正确;B、第二份反应消耗22.4g铁,物质的量为22.4g÷56g/mol=0.4mol。所有的铁元素都在硫酸亚铁中,根据硫酸根守恒可知,每份含硫酸0.4mol,所原混合酸中H2SO4物质的量为0.4mol×2=0.8mol,B不正确;C、由图象可知,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O。由于铁过量,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故C正确;D、酸全部被还原,铁元素全部以硫酸亚铁的形式存在于溶液中,所以溶液中最终溶质为FeSO4,故D正确,答案选B。
考点:考查铁与硝酸、硫酸混合液反应的有关计算

 应用题作业本系列答案
应用题作业本系列答案用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.1mol Na2O2固体中含有O22-2 NA |
| B.常温常压下,3.2 g CH4中含有电子2 NA |
| C.标准状况下,11.2 L CH3CH2OH中含有分子0.5NA |
| D.100 mL 1 mol·L-1的CH3COOH溶液中含有CH3COOH分子0.1 NA |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.1 mol Na2O2固体中含离子总数为4NA |
| B.标准状况下,22.4 L己烷中共价键数目为19NA |
| C.由乙烯和环己烷组成的混合物28g,含电子数为16NA |
| D.1 L浓度为1 mol·L-1的Na2CO3溶液中含有的CO32-数为NA |
下列说法正确的是:
①Cl-的结构示意图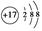 ;
;
②羟基的电子式: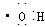 ;
;
③HClO的结构式:H—Cl—O;
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-;
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化( )
| A.①②⑤ | B.①④⑥⑦ | C.②③④⑥ | D.②③⑤⑥⑦ |
NA代表阿伏加德罗常数,下列说法不正确的是
| A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
| B.1 L0.5mol/LNa2CO3溶液中含有的CO32-数目为0.5NA |
| C.标准状况下,2.24L Cl2与足量的Mg充分反应,转移的电子数目为0.2NA |
| D.0.1mol CH4所含的电子数为NA |
下列化学用语正确的是
A.铝离子的结构示意图: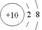 | B.CaH2的电子式:[H:]?Ca2+[:H]- |
C.CO2的比例模型:  | D.核内有8个中子的碳原子: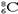 |
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol氢氧化钠的溶液恰好反应完全;另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.(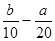 )mol/L )mol/L | B.(2b—a)mol/L | C.(l0b - 5a) mol/L | D.(5b一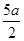 )mol/L )mol/L |
在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·mL-1,质量分数为w,其中含有NH4+的物质的量是b mol,下列叙述正确的是( )
A.溶质的质量分数w=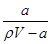 ×100% ×100% |
B.溶质的物质的量浓度c= mol·L-1 mol·L-1 |
C.溶液中c(OH-)=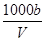 mol·L-1+c(H+) mol·L-1+c(H+) |
| D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w |
 2CaO+O2↑+2nH2O,2CaO2+4HCl=2CaCl2+2H2O+O2↑。现称取2.168 g过氧化钙样品分成两等份进行下列实验:
2CaO+O2↑+2nH2O,2CaO2+4HCl=2CaCl2+2H2O+O2↑。现称取2.168 g过氧化钙样品分成两等份进行下列实验: