题目内容
NA代表阿伏加德罗常数,下列说法不正确的是
| A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
| B.1 L0.5mol/LNa2CO3溶液中含有的CO32-数目为0.5NA |
| C.标准状况下,2.24L Cl2与足量的Mg充分反应,转移的电子数目为0.2NA |
| D.0.1mol CH4所含的电子数为NA |
B
解析试题分析:A、铁与稀硝酸反应时生成硝酸盐,所以一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA,A正确;B、碳酸钠溶于水CO32-水解,因此1 L0.5mol/LNa2CO3溶液中含有的CO32-数目小于0.5NA,B不正确;C、标准状况下,2.24L氯气的物质的量是0.1mol,因此与镁充分反应,转移的电子数目为0.2NA,C正确;D、甲烷是10电子分子,因此0.1mol CH4所含的电子数为NA,D正确,答案选B。
考点:考查阿伏加德罗常数的有关计算

练习册系列答案
相关题目
HF气体分子间容易缔合。某HF气体由HF、(HF)2、 (HF)3三者混合而成,其平均相对分子质量为42,则(HF)3的体积分数可能为
| A.51% | B.56% | C.49% | D.10% |
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.CO2的电子式为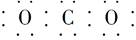 |
B.Cl-的结构示意图为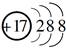 |
| C.乙烯的结构简式为C2H4 |
D.质量数为37的氯原子为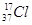 |
下列有关化学用语表示和概念判断叙述正确的是
| A.1molH2燃烧放出的热量为H2的燃烧热 |
B.氢氧根离子的电子式: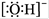 |
C.氯原子的结构示意图: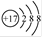 |
D. 和 和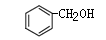 互为同系物 互为同系物 |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是
| A.混合酸中HNO3物质的量浓度为2 mol·L-1 |
| B.原混合酸中H2SO4物质的量为0.4 mol |
| C.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| D.第二份溶液中最终溶质为FeSO4 |
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1Ba(OH)2溶液300 mL(忽略溶液体积变化),反应后溶液中SO42-的物质的量浓度为
| A.0.4 mol·L-1 | B.0.1 mol·L-1 | C.0.2 mol·L-1 | D.0.3 mol·L-1 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 |
| B.标准状况下,1.12 L的HCHO所含的原子数是0.2NA |
| C.1 L0.5mol·L-1Na2CO3溶液中含有的CO32-数目为0.5NA |
| D.0.1 mol Na2O2作供氧剂时转移的电子数目是0.2 NA |
有9.7 g Cu和Zn的合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2. 24 L。将溶液稀释为IL,测得溶液的pH=l,此时溶液中NO—3的浓度为
| A.0.3 mol/L | B.0.4 mol/L | C.0.5 mol/L | D.0.6 mol/L |
下列化学用语或模型表示正确的是
A.硝基苯的结构简式: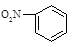 | B.CO2分子比例模型: |
C.NH4Cl的电子式: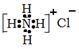 | D.NaCl的晶体模型: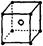 |