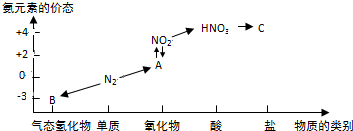
题目内容
20.25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是( )| A. | 在0.1 mol•L-1Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| B. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| C. | 将0.1 mol•L-1盐酸与0.1 mol•L-1K2CO3溶液等体积混合:c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 向0.1 mol•L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
分析 A.根据0.1mol•L-1Na2S溶液中的物料守恒判断;
B.溶液中一定存在电荷守恒,根据混合液中的电荷守恒分析;
C.混合液中溶质为等浓度的氯化钾和碳酸氢钾,碳酸氢根离子部分水解,溶液显示碱性,则c(OH-)>c(H+),结合电荷守恒判断各离子浓度大小;
D.溶液为中性,则c(OH-)=c(H+),根据电荷守恒可得:c(Na+)+c(NH4+)=2c(SO42-),混合液为中性,加入的氢氧化钠的物质的量稍大于0.1mol.
解答 解:A.根据0.1mol•L-1Na2S溶液中的物料守恒可得:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),故A错误;
B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故B正确;
C.将0.1 mol•L-1盐酸与0.1 mol•L-1K2CO3溶液等体积混合,反应生成碳酸氢钾,反应后溶质为氯化钾和碳酸氢钾,碳酸氢根离子部分水解,溶液显示碱性,c(OH-)>c(H+),溶液中离子浓度大小为:c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+),故C正确;
D.向0.1 mol•L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性,则c(OH-)=c(H+),氢氧化钠的物质的量应该稍大些,则c(Na+)>c(SO42-),根据电荷守恒可得:c(Na+)+c(NH4+)=2c(SO42-),则c(SO42-)>c(NH4+),溶液中离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D错误;
故选BC.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题侧重考查学生的分析理解能力.

| A. | 含0.1 mol.L-1SO2的溶液.中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、N03-、SO42- | |
| C. | $\frac{C{(H}^{+})}{C({OH}^{-})}$=10-12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、ClO-、I- |
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pX=-lgc(X).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pX=-lgc(X).下列说法正确的是( )| A. | 在该温度下,MgCO3、MnCO3 的溶解度依次增大 | |
| B. | d点可表示MnCO3的过饱和溶液,且c(Mn2+)>c(CO32-) | |
| C. | b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) | |
| D. | c点可表示MgCO3 的不饱和溶液,且c(Mg2+)>c(CO32-) |
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) | |
| B. | 1.0 mol•L-1Na2C2O4溶液:c(OH-)=c(HC2O4-)+c(H+)+c(H2C2O4) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:c(OH-)+c(A-)=c(H+)+c(HA) |
| A. | 18ml | B. | 大于18ml | C. | 小于18ml | D. | 无法判断 |
| A. | M(NO3)2 | B. | M(NO3)3 | C. | MNO3 | D. | M2(NO3)2 |
 .
.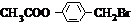 +3NaOH$→_{△}^{水}$CH3COONa+
+3NaOH$→_{△}^{水}$CH3COONa+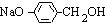 +NaBr+H2O,
+NaBr+H2O,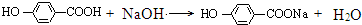 .
.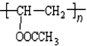 在氢氧化钠溶液中加热:
在氢氧化钠溶液中加热: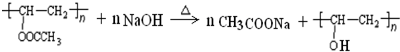 .
.