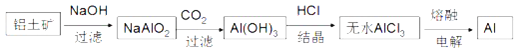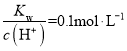题目内容
【题目】下表是某同学探究Na2SO3溶液和铬(VI)盐溶液反应规律的实验记录,已知:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+
2CrO42-(黄色)+ 2H+
序号 | a | b | 现象 | |
| 1 | 2 mL 0.05 mol·L1 K2Cr2O7溶液(pH = 2) | 3滴饱和Na2SO3溶液(pH = 9) | 溶液变绿色(含Cr3+) |
2 | 2 mL 0.1 mol·L1 K2CrO4溶液(pH = 8) | 3滴饱和Na2SO3溶液 | 溶液没有明显变化 | |
3 | 2 mL饱和Na2SO3溶液 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变黄色 | |
4 | 2 mL蒸馏水 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变成浅橙色 |
下列说法不正确的是
A. 实验1中的绿色溶液中含有SO42-
B. 实验1、2的a溶液中所含的离子种类相同
C. 向实验3溶液中继续滴加过量硫酸可使溶液变为浅橙色
D. 实验4的目的是排除稀释对溶液颜色变化造成的影响
【答案】C
【解析】
由4个实验结果对比可知,K2Cr2O7与Na2SO3在酸性条件下发生氧化还原反应,在碱性条件下不发生氧化还原反应;由平衡Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+可知,溶液的碱性增强,平衡正向移动,以此分析。
2CrO42-(黄色)+ 2H+可知,溶液的碱性增强,平衡正向移动,以此分析。
A. 实验1中K2Cr2O7与Na2SO3发生了氧化还原反应,Na2SO3被氧化为Na2SO4,K2Cr2O7被还原为Cr3+,溶液呈绿色,故A正确;
B. 实验1、2中的a溶液中都存在平衡:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+,故溶液中所含的离子种类相同,故B正确;
2CrO42-(黄色)+ 2H+,故溶液中所含的离子种类相同,故B正确;
C.Na2SO3溶液呈碱性,滴加3滴0.05 mol·L1 K2Cr2O7溶液,平衡Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+向正向移动,溶液呈黄色;若向实验3溶液中继续滴加过量硫酸,则在酸性条件下,K2Cr2O7与Na2SO3发生氧化还原反应,溶液变绿色,故C错误;
2CrO42-(黄色)+ 2H+向正向移动,溶液呈黄色;若向实验3溶液中继续滴加过量硫酸,则在酸性条件下,K2Cr2O7与Na2SO3发生氧化还原反应,溶液变绿色,故C错误;
D. 实验4和实验3相比,b溶液相同,a为等体积的蒸馏水,溶液由黄色变成浅橙色,颜色反而加深,故可排除稀释对溶液颜色变化造成的影响,故D正确。
故选C。

 阅读快车系列答案
阅读快车系列答案