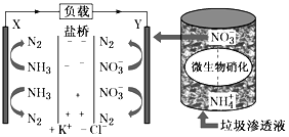
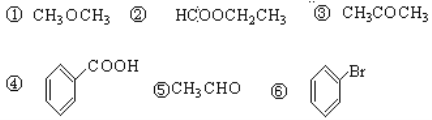
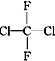
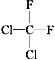
题目内容
【题目】在密闭容器里,发生反应2A(g)+B(g)![]() 2C(g)。下列条件不能说明该反应达到平衡的是
2C(g)。下列条件不能说明该反应达到平衡的是
A.2υ正(B)=υ逆(C)
B.该体系的密度不随时间而变化
C.该体系的温度不随时间而变化
D.1molA的化学键断裂,同时1molC的化学键也断裂
【答案】B
【解析】
A.2v正(B)=v逆(C)=2v逆(B),B的正、逆反应速率相等,该反应达到平衡状态,故A不选;
B.该反应前后混合气体的质量不变、容器的体积不变,气体的密度始终不变,所以该体系的密度不随时间变化时,该反应不一定达到平衡状态,故B选;
C.该反应的正反应无论是吸热反应还是放热反应,随着反应的进行反应体系温度一定改变,当该体系的温度不随时间而变化时,说明正、逆反应速率相等,反应达到平衡状态,故C不选;
D.1 molA的化学键断裂,反应正向进行,同时1molC的化学键也断裂,反应逆向进行,同时生成1molA,A的正、逆反应速率相等,该反应达到平衡状态,故D不选;
故选B。

 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】下表是某同学探究Na2SO3溶液和铬(VI)盐溶液反应规律的实验记录,已知:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+
2CrO42-(黄色)+ 2H+
序号 | a | b | 现象 | |
| 1 | 2 mL 0.05 mol·L1 K2Cr2O7溶液(pH = 2) | 3滴饱和Na2SO3溶液(pH = 9) | 溶液变绿色(含Cr3+) |
2 | 2 mL 0.1 mol·L1 K2CrO4溶液(pH = 8) | 3滴饱和Na2SO3溶液 | 溶液没有明显变化 | |
3 | 2 mL饱和Na2SO3溶液 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变黄色 | |
4 | 2 mL蒸馏水 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变成浅橙色 |
下列说法不正确的是
A. 实验1中的绿色溶液中含有SO42-
B. 实验1、2的a溶液中所含的离子种类相同
C. 向实验3溶液中继续滴加过量硫酸可使溶液变为浅橙色
D. 实验4的目的是排除稀释对溶液颜色变化造成的影响