题目内容
16.室温下,某研究小组为探究影响CaCO3与盐酸反应速率的因素,进行了如下实验.(1)测定0.5mol•L-1盐酸与CaCO3固体的反应速率.
方案1:通过测定生成CO2的体积(或质量)和反应时间计算反应速率;
方案2:通过测定消耗CaCO3固体的质量和反应时间计算反应速率;
(2)探究固体表面积或反应物浓度对化学反应速率的影响.限选试剂与用品:0.5mol•L-1盐酸、块状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
①设计实验:在固体表面积或反应物浓度不同的条件下,通过如图1实验装置测定生成等质量CO2所需的时间(或相同时间内生成的CO2的质量)来直接体现反应速率大小.

②参照下表格式,拟定实验表格,完整体现实验方案(写出所选试剂的状态及体积,需测定的物理量数据可用字母表示).
 | V(0.5mol•L-1 HCl)/mL | m(CaCO3)/g | CaCO3状态 | V(蒸馏水)/mL | 实验目的 | |
| 实验1 | 40.0 | 0.8 | ①实验1和2探究固体表面积对反应速率的影响; ②实验1和3探究反应物浓度对反应速率的影响 | |||
| 实验2 | 40.0 | 0.8 | ||||
| 实验3 | 60.0 | 0.8 |
分析 (1)测定CaCO3固体与过量0.1mol•L-1 HCl的反应速率,可以根据单位时间内二氧化碳的生成量或单位时间内碳酸钙的消耗量判断反应速率;
(2)①在固体表面积或反应物浓度不同的条件下,通过测定单位时间内二氧化碳的生成速率判断反应速率;
②据盐酸浓度相同时,块状碳酸钙与粉末状碳酸钙生成二氧化碳的速率和碳酸钙状态相同盐酸浓度不同时生成二氧化碳速率进行实验;
(3)根据计算所得数据在图丁中画出产生沉淀的曲线.
解答 解:(1)可以根据单位时间内二氧化碳的生成量或单位时间内碳酸钙的消耗量判断反应速率,即测定生成二氧化碳的体积(或质量)和反应时间,或测定消耗碳酸钙固体的质量和反应时间,
故答案为:生成二氧化碳的体积(或质量);反应时间;消耗碳酸钙固体的质量;反应时间;
(2)①在固体表面积或反应物浓度不同的条件下,通过测定单位时间内二氧化碳的生成速率判断反应速率,故答案为:生成等质量CO2所需的时间(或相同时间内生成的CO2的质量);
②据盐酸浓度相同时,块状碳酸钙与粉末状碳酸钙生成二氧化碳的速率和碳酸钙状态相同盐酸浓度不同时生成二氧化碳速率进行实验,
| 物理量 实验序号 | V(0.5mol/L的HCl)/mL | m(块状碳酸钙质量)/g | m(粉末状碳酸钙质量)/g | V(蒸馏水)/mL | m(二氧化碳)/g | 反应时间 t/s |
| 实验1 | 40 | 0.8 | 60 | d | ||
| 实验2 | 40 | 0.8 | 60 | d | ||
| 实验3 | 60 | 0.8 | 40 | d |
| 物理量 实验序号 | V(0.5mol/L的HCl)/mL | m(块状碳酸钙质量)/g | m(粉末状碳酸钙质量)/g | V(蒸馏水)/mL | m(二氧化碳)/g | 反应时间 t/s |
| 实验1 | 40 | 0.8 | 60 | d | ||
| 实验2 | 40 | 0.8 | 60 | d | ||
| 实验3 | 40 | 0.8 | 40 | d |
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 2
0.8 40×0.5×10-3
因为$\frac{40×0.5×1{0}^{-3}}{2}>\frac{0.8}{100}$
所以盐酸过量,过量的盐酸的量为:0.02-0.016=0.004mol,
所以首先发生Na2CO3+2HCl=CaCl2+H2O+CO2↑,
1 2
0.1×V 0.004
所以V=0.02L=20mL,所以横坐标为20mL的时候开始出现沉淀,
CaCl2+Na2CO3=CaCO3↓+2NaCl
1 1
0.008 0.1×V1
即V1=0.08L=80mL,也就是100ml的时刻沉淀达最大值,后来再滴入碳酸钠沉淀不溶解,所以图象为:
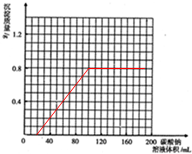 ,
,故答案为:
 .
.点评 本题考查了化学反应速率的求算以及化学反应速率的实验测定,题目难度较大.

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
2.已知0.1mol•L-1邻苯二甲酸(二元酸)溶液的pH大于1,取等体积的邻苯二甲酸溶液和某KOH溶液混合,测得混合液的pH等于7,则碱与酸的浓度比值(X)为( )
| A. | X>2 | B. | X=2 | C. | 2>X>1 | D. | X=1 |
3.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收akJ的能量.下列说法正确的是( )
①石墨不如金刚石稳定
②金刚石不如石墨稳定
③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
④等质量的石墨和金刚石完全燃烧,石墨放出的能量多.
①石墨不如金刚石稳定
②金刚石不如石墨稳定
③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
④等质量的石墨和金刚石完全燃烧,石墨放出的能量多.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
4.2004年4月15日晚,重庆市江北区天原化工总厂发生氯气泄露事件,消防人员采用消防用水与碱液在外围50米外形成两道水幕进行稀释,稀释后的水进入了天原化工总厂的下水道,有全面的消毒措施.下列适用于消毒用的碱是( )
| A. | 浓氨水 | B. | NaOH | C. | Ba(OH)2 | D. | Ca(OH)2 |
8.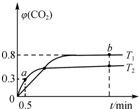 利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
 利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | T1<T2,△H>0 | |
| B. | T1温度下,该反应的平衡常数为1 024 | |
| C. | T2温度下,0~0.5 min内,CO的平均反应速率为0.3 mol•L-1•min-1 | |
| D. | T1温度下,若向装有足量I2固体的2 L恒容密闭容器中通入10 mol CO2,达到平衡时,φ(CO2)=0.8 |
6.现有部分短周期元素的性质或原子结构如下表:
(1)写出元素X的离子结构示意图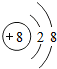 .写出元素Z的单质的电子式
.写出元素Z的单质的电子式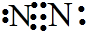 (用元素符号表示)
(用元素符号表示)
(2)写出Y元素的硫酸盐溶于水的电离方程式Al2(SO4)3═2Al3++3SO42-;
(3)元素T在周期表中的位置是第二周期ⅤⅡA族;下列表述能比较T与氯元素非金属性强弱的事实是cd
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的气态氢化物比氯化氢稳定.
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | 原子最外层电子数是次外层的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 气态氢化物与最高氧化物对应水化物可发生化合反应 |
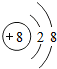 .写出元素Z的单质的电子式
.写出元素Z的单质的电子式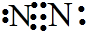 (用元素符号表示)
(用元素符号表示)(2)写出Y元素的硫酸盐溶于水的电离方程式Al2(SO4)3═2Al3++3SO42-;
(3)元素T在周期表中的位置是第二周期ⅤⅡA族;下列表述能比较T与氯元素非金属性强弱的事实是cd
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的气态氢化物比氯化氢稳定.

