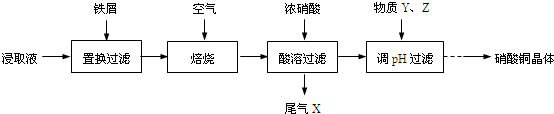
题目内容
1.下列说法正确的是( )| A. | 常温pH=11的烧碱溶液与pH=3的稀醋酸等体积混合后,滴入石蕊试液呈红色 | |
| B. | T℃时,pH=6的纯水中,含10-8NA个OH-(NA表示阿伏加德罗常数) | |
| C. | 将NaAlO2、FeCl3、Al2(SO4)3的水溶液分别在蒸发皿中加热、蒸干并灼烧,都能得原溶质 | |
| D. | 常温下由水电离的c(H+)=1×10-13mol/L的溶液里,能大量存在NH4+、Fe2+、NO3- |
分析 A.常温下,pH=11的NaOH溶液浓度小于pH=3的醋酸浓度,二者等体积混合醋酸有剩余,溶液呈酸性;
B.溶液体积未知无法计算氢氧根离子个数;
C.氯化铁水解生成氢氧化铁和盐酸,盐酸具有挥发性;
D.常温下由水电离的c(H+)=1×10-13mol/L的溶液呈酸性或碱性.
解答 解:A.常温下,pH=11的NaOH溶液浓度小于pH=3的醋酸浓度,二者等体积混合醋酸有剩余,溶液呈酸性,紫色石蕊试液遇酸变红色,所以常温pH=11的烧碱溶液与pH=3的稀醋酸等体积混合后,滴入石蕊试液呈红色,故A正确;
B.T℃时,pH=6的纯水中,c(H+)=c(OH-)=1×10-6mol/L,但溶液体积未知无法计算氢氧根离子个数,故B错误;
C.氯化铁水解生成氢氧化铁和盐酸,盐酸具有挥发性,所以蒸干氯化铁溶液得到氢氧化铁固体,灼烧氢氧化铁得到的固体是氧化铁,故C错误;
D.常温下由水电离的c(H+)=1×10-13mol/L的溶液呈酸性或碱性,酸性条件下,Fe2+、NO3-发生氧化还原反应而不能共存,碱性条件下,NH4+、Fe2+和OH-发生反应而不能大量共存,故D错误;
故选A.
点评 本题考查较综合,涉及离子共存、物质的量的计算、盐类水解、酸碱混合溶液定性判断等知识点,明确物质的性质及物质的量的有关公式即可解答,易错选项是D.

练习册系列答案
相关题目
12.某有机物的结构简式为: ,下列说法不正确的是( )
,下列说法不正确的是( )
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 该有机物的分子式为C6H8O2,属于芳香烃 | |
| B. | 该有机物能与FeCl3溶液发生显色反应 | |
| C. | 该有机物中所有原子不可能在同一平面 | |
| D. | 1mol该有机物与足量的Na反应可产生1molH2 |
9.下列说法正确的是( )
| A. | 室温下,将pH=2的醋酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| B. | 室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 | |
| C. | 向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| D. | 为保护地下钢管不受腐蚀,可将它与直流电源的负极相连 |
16.在一定条件下,对于A2(g)+3B2(g)?2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最大的是( )
| A. | v(A2)=0.8mol•L-1•s-1 | B. | v(A2)=60mol•L-1•min-1 | ||
| C. | v(AB3)=1.0mol•L-1•s-1 | D. | v(B2)=1.2mol•L-1•s-1 |
6.下列有关物质的用途错误的是( )
| A. | 水玻璃可用作木材防火剂 | B. | 二氧化硅是制造光导纤维的材料 | ||
| C. | 可用氢氟酸刻蚀玻璃 | D. | 石英是制造太阳能电池的常用材料 |
13.若表为周期表的一部分,其中M的单质与水反应时,水作还原剂,下列说法正确的是( )
| Y | X | M | ||
| Z | W |
| A. | 最低价离子半径Y、X、M依次减小 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 工业上通过电解Z的氯化物来冶炼Z单质 | |
| D. | Y、W、X三种元素最低价氢化物的沸点依次升高 |
10.下列叙述正确的是( )
| A. | 第三周期元素形成的简单离子中半径最小的是Na+ | |
| B. | 同周期元素(过渡元素和0族元素除外)从左到右,原子半径逐渐减小 | |
| C. | 带ⅦA族元素从上到小,其氢化物的稳定性逐渐增强 | |
| D. | 同主族元素从上到下,单质的熔点逐渐降低 |
11.下列实验中,所选装置不合理的是( )
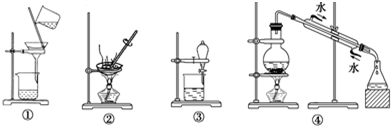

| A. | 分离Na2CO3溶液和CH3COOC2H5,选③ | |
| B. | 用CCl4提取碘水中的碘,选③和④ | |
| C. | 除去氯化钠中的少量硝酸钾固体,选②和① | |
| D. | 模拟血液透析,选① |