题目内容
13.下列各组元素性质递变情况正确的是( )| A. | H、Be、B原子最外层电子数依次增多 | B. | P、S、Cl元素最高正化合价依次降低 | ||
| C. | C、N、O、F原子半径依次增大 | D. | Li、Na、K、Rb的金属性依次减弱 |
分析 A.H、Be、B原子最外层电子数分别为1、2、3;
B.P、S、Cl元素最高正化合价等于最外层电子数,分别为5、6、7;
C.C、N、O、F为同周期元素,原子序数大的原子半径小;
D.Li、Na、K、Rb为同主族元素,原子序数大的金属性强.
解答 解:A.H、Be、B原子最外层电子数分别为1、2、3,则最外层电子数依次增多,故A正确;
B.P、S、Cl元素最高正化合价等于最外层电子数,分别为5、6、7,则最高正化合价依次升高,故B错误;
C.C、N、O、F为同周期元素,原子序数大的原子半径小,则原子半径依次减小,故C错误;
D.Li、Na、K、Rb为同主族元素,原子序数大的金属性强,则金属性依次增强,故D错误;
故选A.
点评 本题考查元素周期律和元素周期表,为高频考点,把握元素的位置、元素的性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.在一定条件下,对于密闭容器中进行的反应:2SO2(g)+O2(g)?2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是( )
| A. | 正、逆反应速率都等于零 | B. | SO2、O2、SO3的浓度相等 | ||
| C. | SO2、O2、SO3在容器中共存 | D. | SO2、O2、SO3的浓度均不再变化 |
8.由1,3丁二烯合成氯丁橡胶的过程中,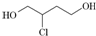 是一种中间产物.下列说法正确的是( )
是一种中间产物.下列说法正确的是( )
 是一种中间产物.下列说法正确的是( )
是一种中间产物.下列说法正确的是( )| A. | 1,3丁二烯分子式为C4H8 | |
| B. | 1,3丁二烯转化为 时,先与Cl2发生1,4加成再水解得到 时,先与Cl2发生1,4加成再水解得到 | |
| C. |  在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应 在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应 | |
| D. |  催化氧化得X,X能发生银镜反应,则X的结构只有两种 催化氧化得X,X能发生银镜反应,则X的结构只有两种 |
18.下列说法正确的是( )
| A. | 将AgNO3溶液滴入氨水中制银氨溶液 | |
| B. | 苯酚与苯甲醇(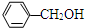 )分子组成相差一个-CH2原子团,因而它们互为同系物 )分子组成相差一个-CH2原子团,因而它们互为同系物 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 苯酚分子中由于羟基对苯环的影响,使苯环上的氢原子容易被取代 |
5.把下列物质分别加入(或通入)溴水中,不会褪色的是( )
| A. | 苯 | B. | 乙烯 | C. | 乙醇 | D. | KMnO4溶液 |
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| B. | 常温常压下,22.4 L CH4中含有的C-H键数为4NA | |
| C. | 含0.2 mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA | |
| D. | lmol FeCl2与足量氯气反应时转移的电子数为2NA |