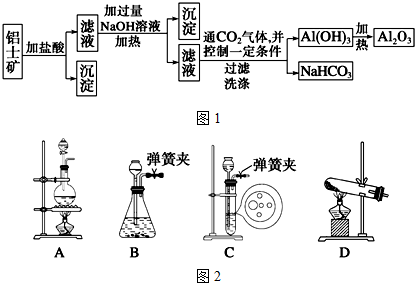
题目内容
1.X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布.H2在X单质中燃烧,产生苍白色火焰;Y元素的气态氢化物是H2Y,其最高价氧化物中Y的质量分数为40%;Z元素和氮元素在同一族.(1)根据以上条件,推断XCl,YS,ZP(填写元素符号);
(2)写出Z元素的最高价氧化物的水化物的化学式:H3PO4;
(3)写出它们气态氢化物稳定性由小到大顺序PH3<H2S<HCl(填写化学式)
分析 X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布,H2在X单质中燃烧,产生苍白色火焰,则X是Cl元素;Y元素的气态氢化物是H2Y,Y最低负化合价为-2,位于第VIA族,其离子结构和氩原子电子层结构相同,所以Y是S元素,其最高价氧化物为SO3,S元素的质量分数为40%;Z元素和氮元素在同一族,则Z为P元素,据此解答.
解答 解:X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布,H2在X单质中燃烧,产生苍白色火焰,则X是Cl元素;Y元素的气态氢化物是H2Y,Y最低负化合价为-2,位于第VIA族,其离子结构和氩原子电子层结构相同,所以Y是S元素,其最高价氧化物为SO3,S元素的质量分数为40%;Z元素和氮元素在同一族,则Z为P元素.
(1)由上述分析可知,X为Cl;Y为S,Z为P,故答案为:Cl;S;P;
(2)Z为P元素,其最高价氧化物的水化物的化学式:H3PO4,故答案为:H3PO4;
(3)非金属性P<S<Cl,故氢化物稳定性:PH3<H2S<HCl,故答案为:PH3<H2S<HCl.
点评 本题主要考查位置结构性质关系的相互应用,比较基础,推断元素是解题关键,有利于基础知识的巩固.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
9.下列关于碱金属元素说法正确的是( )
| A. | 单质都能在O2中燃烧生成过氧化物 | |
| B. | 从Li到Cs,密度越来越大,熔点越来越低 | |
| C. | 单质都可以保存在煤油中 | |
| D. | 单质都是强还原剂,与水反应都生成强碱 |
16.ClO-、ClO2-、ClO3-、ClO4-中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构
| 微粒 | ClO- | ClO2- | ClO3- | ClO4- |
| 立体结构 | 直线 | V型 | 三角锥形 | 正四面体 |
6.有机物X具有下列性质:①与FeCl3溶液作用发生显色反应;②能发生加成反应;③能与溴水发生反应.依据以上信息,可以得出的推论是( )
| A. | 有机物X是一种芳香烃 | |
| B. | 有机物X可能不含双键结构 | |
| C. | 有机物X不能与Na2CO3 溶液反应 | |
| D. | 有机物X一定含有碳碳双键或碳碳三键 |
13.下列各组元素性质递变情况正确的是( )
| A. | H、Be、B原子最外层电子数依次增多 | B. | P、S、Cl元素最高正化合价依次降低 | ||
| C. | C、N、O、F原子半径依次增大 | D. | Li、Na、K、Rb的金属性依次减弱 |
11.已知C5H11Cl共有8种同分异构体,可推知分子式为C5H12O属于醇类的同分异构体的数目共有( )
| A. | 9种 | B. | 6 种 | C. | 5种 | D. | 8种 |
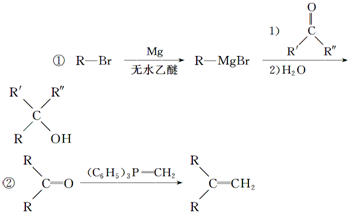 (R表示烃基,R和R表示烃基或氢)
(R表示烃基,R和R表示烃基或氢) .
.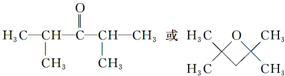 (任写一种).
(任写一种).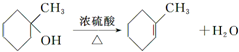 .
.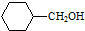 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2+CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2+CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.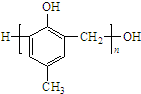 )的合成路线如下:
)的合成路线如下: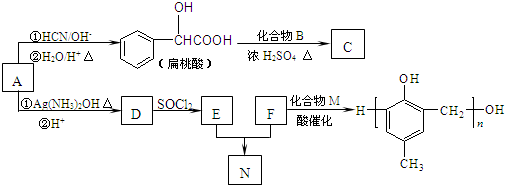
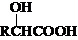
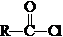 $\stackrel{R′OH}{→}$RCOOR′(R、R′代表烃基)
$\stackrel{R′OH}{→}$RCOOR′(R、R′代表烃基)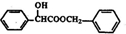 .
.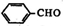 +2Ag(NH3)2OH$\stackrel{水浴加热}{→}$
+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$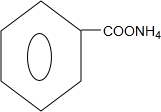 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.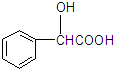 )有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体共有13种,写出其中一种含亚甲基(-CH2-)的同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体共有13种,写出其中一种含亚甲基(-CH2-)的同分异构体的结构简式 .
.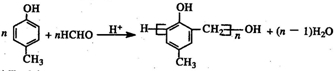 .
.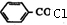 +
+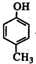 →
→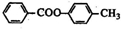 +HCl.
+HCl.