题目内容
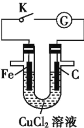
【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是( )
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-= SO32-+H2O
C. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
D. 进入离心机的分散系是悬浊液
【答案】C
【解析】
A.酸雨产生的主要原因是SO2和氮氧化物的排放,所以向大气中排放SO2可能导致酸雨发生,故A正确;
B. 吸收塔中发生的反应为CO32-+2SO2+H2O=CO2+2HSO3-,所以中和器中的主要作用是将HSO3-转化为SO32-,HSO3-和OH-发生反应,离子方程式为:HSO3-+OH- = SO32-+H2O,故B正确;
C. Ba(NO3)2电离出NO3-,NO3-在酸性条件下会将SO32-氧化为SO42-,不能检验出Na2SO3成品中是否含Na2SO4,故C错误;
D. 从中和器中出来的是含有晶体颗粒的溶液,是悬浊液,故D正确;
故答案为:C。

【题目】实验小组同学对乙醛与新制的Cu(OH)2反应的实验进行探究。
实验Ⅰ:取2mL 10%的氢氧化钠溶液于试管中,加入5滴2%的CuSO4溶液和5滴5%的乙醛溶液,加热时蓝色悬浊液变黑,静置后未发现红色沉淀。
实验小组对影响实验Ⅰ成败的因素进行探究:
(1)探究乙醛溶液浓度对该反应的影响。
编号 | 实验Ⅱ | 实验Ⅲ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变红棕色,静置后底部有大量红色沉淀 | 加热,蓝色悬浊液变红棕色,静置后上层为棕黄色油状液体,底部有少量红色沉淀 |
已知:乙醛在碱性条件下发生缩合反应:CH3CHO+CH3CHO![]() CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
① 能证明乙醛被新制的Cu(OH)2 氧化的实验现象是______。
② 乙醛与新制的Cu(OH)2 发生反应的化学方程式是______。
③ 分析实验Ⅲ产生的红色沉淀少于实验Ⅱ的可能原因:______。
(2)探究NaOH溶液浓度对该反应的影响。
编号 | 实验Ⅳ | 实验Ⅴ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,蓝色悬浊液变红棕色, 静置后底部有红色沉淀 |
依据实验Ⅰ→Ⅴ,得出如下结论:
ⅰ. NaOH溶液浓度一定时,适当增大乙醛溶液浓度有利于生成Cu2O。
ⅱ. 乙醛溶液浓度一定时,______。
(3)探究NaOH溶液浓度与乙醛溶液浓度对该反应影响程度的差异。
编号 | 实验Ⅵ | 实验Ⅶ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,静置后底部有红色沉淀 |
由以上实验得出推论: ______。