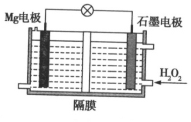
题目内容
【题目】下列实验操作中,根据实验现象得出的结论正确的是
选项 | 操作 | 现象 | 结论 |
A |
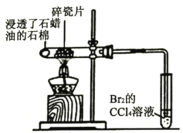
| Br2的CCl4溶液褪色 | 石蜡油分解产生乙烯气体 |
B |
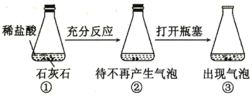
| ③中出现气泡 | 可以用平衡移动原理解释 |
C |
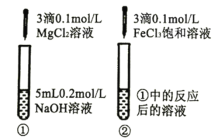
| ①中出现白色沉淀 ②中出现红褐色沉淀 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
D |
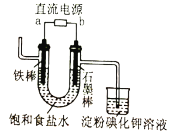
| 淀粉碘化钾溶液变蓝 | b为直流电源负极 |
A.AB.BC.CD.D
【答案】B
【解析】
A.将石蜡油分解产生的气体通入到Br2的CCl4溶液中褪色,可以说明气体中含有不饱和烃,并不能说明分解产物都是烯烃,更不能确定产生的是乙烯,故A错误;
B.稀盐酸与石灰石反应生成二氧化碳,二氧化碳在水中存在溶解平衡,CO2+H2OH2CO3塞上瓶塞时压强较大,平衡正向移动,不会有气泡生成,打开瓶塞后压强减小,平衡逆向移动,生成气泡,可用平衡移动原理解释,故B正确;
C.向5mL0.2molL1NaOH溶液中滴加3滴0.1molL1 MgCl2溶液生成氢氧化镁白色沉淀,但NaOH过量,再滴加3滴饱和0.1molL1FeCl3溶液产生的氢氧化铁沉淀可能是过量的NaOH与FeCl3反应产生的,不能确定是由氢氧化镁沉淀转化得到的,即不属于沉淀的转化,不能比较二者的溶度积大小,故C错误;
D.淀粉碘化钾溶液变蓝,说明与b相连的电极产生氯气将碘离子氧化为碘单质,则与b相连的电极发生的电极反应为2Cl--2e-=Cl2↑,该电极为阳极,则b为电源的正极,故D错误;
答案选B。

练习册系列答案
相关题目