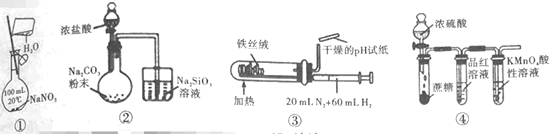
��Ŀ����
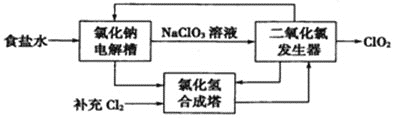
����Ŀ���������(NH4ClO4)����������ƽ����ȡ��Ʊ�NH4ClO4�Ĺ����������£�
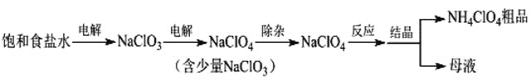
(1)���NaClO3��Һʱ��ClO3-��____��������Ӧ����缫��ӦʽΪ____��
(2)�������������ַ�����
�ٷ���1�����������H2O2��Һ��NaClO3ת��ΪClO2����ѧ����ʽΪ______��
����2�����백ˮ��FeCl24H2O��NaClO3ת��ΪCl-�����ӷ���ʽΪ____�����FeCl24H2O��������ֺ�ɫ���Գ������ó���������______��(�ѧʽ)
�ڱȽ������ԣ�ClO3-_____ClO4-(����>������<��)��
�����ַ�����ȣ�����1���ŵ���____��(��һ������)
(3)����Ӧ��ʱ��NaClO4��NH4Cl��90���Ʊ�NH4ClO4�������Ũ�����Һ������NH4Cl����������ȣ�ԭ����____��
(4)�������п�ѭ�����õ�������_________��(�ѧʽ)
���𰸡��� ClO3-+H2O-2e- =ClO4-+2H+ 2NaClO3+2HCl+H2O2=2ClO2��+2NaCl+2H2O+O2�� 6Fe2++ClO3-+3H2O+12NH3H2O=6Fe(OH)3��+Cl-+12NH4+ Fe3O4 ![]() ���������(�������H2O2�׳�ȥ�Ⱥ�����) Ũ�����Һ���ķ�ӦΪ���ȷ�Ӧ NaCl
���������(�������H2O2�׳�ȥ�Ⱥ�����) Ũ�����Һ���ķ�ӦΪ���ȷ�Ӧ NaCl
��������
(1)��������ӻ��ϼ�Ϊ+5�����ߵ�����������ӵ�+7�ۣ�����������Ӧ��Ϊ������Ӧ��
(2)��˫��ˮ�������ƻ�ԭΪ�������ȣ���ˮ���������ӡ���������ӷ�Ӧ���������ӡ���������������笠����ӣ����FeCl24H2O��������ֺ�ɫ���Գ���������������
�ڸ������Ϸ�������������������Դ��ڸ���������ӣ�
�۷���1���ŵ��Dz��������
(3)Ũ�����Һ��Ϊ���ȷ�Ӧ��
(4)���������жϡ�
(1)��������ӻ��ϼ�Ϊ+5�����ߵ�����������ӵ�+7�ۣ�����������Ӧ��������������Ӧ����ӦʽΪ��ClO3-+H2O-2e- =ClO4-+2H+��
(2)��˫��ˮ�������ƻ�ԭΪ�������ȣ�����ʽΪ��2NaClO3+2HCl+H2O2=2ClO2��+2NaCl +2H2O+O2������ˮ���������ӡ���������ӷ�Ӧ���������ӡ���������������笠����ӣ����ӷ���ʽΪ��6Fe2++ClO3-+3H2O+12NH3H2O=6Fe(OH)3��+Cl-+12NH4+�����FeCl24H2O��������ֺ�ɫ���Գ������ó���������������������
�ڸ������Ϸ�������������������Դ��ڸ���������ӣ�
�����ַ�����ȣ�����1���ŵ��Dz��������(�������H2O2�׳�ȥ�Ⱥ�����)��
(3)����Ũ�����Һ���ķ�ӦΪ���ȷ�Ӧ���ʷ�Ӧ������ȣ�
(4)�������̿�֪���������п�ѭ�����õ��������Ȼ��ơ�

 53���ò�ϵ�д�
53���ò�ϵ�д�