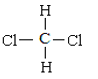
题目内容
【题目】氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)ClO2是一种高效安全的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:
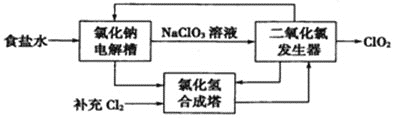
①写出氯化钠电解槽内发生反应的离子方程式:________________________。
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目:_____________。
(2)甲醇燃料电池是采用铂作电极催化剂,其工作原理的示意图如下:
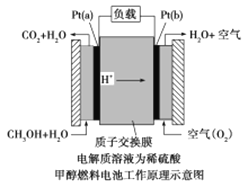
请回答下列问题:
Pt(a)电极是电池的_______极,电极反应式为______________________;
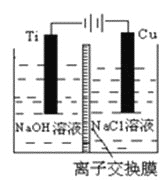
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为______________________________________。
【答案】Cl-+3H2O![]() 3H2↑+ClO3-
3H2↑+ClO3- ![]() =2ClO2↑+2NaCl+Cl2↑+2H2O 负 CH3OH-6e-+H2O=CO2↑+6H+ 2Cu-2e-+2OH-=Cu2O+ H2O
=2ClO2↑+2NaCl+Cl2↑+2H2O 负 CH3OH-6e-+H2O=CO2↑+6H+ 2Cu-2e-+2OH-=Cu2O+ H2O
【解析】
(1)①根据流程图判断电解食盐水得到氯酸钠;
②ClO2发生器中,NaClO3和盐酸发生反应,生成NaCl、ClO2、Cl2、H2O;
(2)燃料从负极通入,电解质为酸性介质,则产物为二氧化碳;
(3)制备纳米Cu2O,故铜电极为阳极。
(1)①根据流程图可以知道:食盐水电解得出到氯酸钠,根据电解池原理,Cl-失电子,在阳极放电,则阴极放电的是H+,生成氢气,其电解离子方程式为:Cl-+3H2O![]() 3H2↑+ClO3-;
3H2↑+ClO3-;
②ClO2发生器中,NaClO3和盐酸发生反应,生成NaCl、ClO2、Cl2、H2O,用化学方程式表示并标出电子转移的方向及数目为:![]() =2ClO2↑+2NaCl+Cl2↑+2H2O;
=2ClO2↑+2NaCl+Cl2↑+2H2O;
(2)在燃料电池中,燃料从负极通入,故Pt(a)电极是电池的负极,电解质为酸性介质,电极反应式为CH3OH-6e-+H2O=CO2↑+6H+;
(3)制备纳米Cu2O,故铜电极为阳极,电极反应为:2Cu-2e-+2OH-=Cu2O+ H2O。