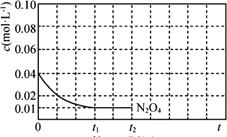
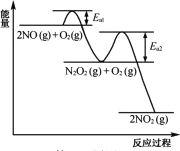
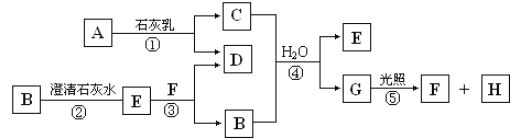
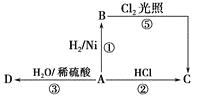
题目内容
【题目】NA为阿伏伽德罗常数,下列说法正确的是( )
A.在反应中消耗0.1molCl2,转移的电子数一定为0.2NA
B.15gCH3+(碳正离子)中含有的电子数为8NA
C.标准状况下,11.2L乙炔中含共用电子对的数目为1.5NA
D.0.1L 2mol/L的(NH4)2S溶液中含有的S2-数目为0.2NA
【答案】B
【解析】
A.氯气发生氧化还原反应可以是自身氧化还原反应,也可以只做氧化剂。
B.1个CH3+(碳正离子)含有8个电子。
C.乙炔中既有碳碳三键又有C-H键。
D.硫离子为弱根离子,部分发生水解。
A. 0.1mol氯气参加氧化还原反应,自身氧化还原反应转移电子0.1mol,也可以只做氧化剂转移的电子数为0.2NA,故A错误。
B. 1个![]() (碳正离子)含有8个电子,15g
(碳正离子)含有8个电子,15g![]() (碳正离子)的物质的量为1mol,含有电子数为8NA,故B正确。
(碳正离子)的物质的量为1mol,含有电子数为8NA,故B正确。
C. 标准状况下,11.2L乙炔中共用电子对有碳碳三键又有C-H键功0.5NA×(3+2)=2.5 NA,故C错误。
D.![]() 的(NH4)2S溶液含有硫化铵的物质的量为0.2mol,但是硫离子为弱根离子,部分发生水解,所以含有的
的(NH4)2S溶液含有硫化铵的物质的量为0.2mol,但是硫离子为弱根离子,部分发生水解,所以含有的![]() 数目小于0.2NA,故D错误。
数目小于0.2NA,故D错误。
故选:B。

练习册系列答案
相关题目