题目内容
25℃时,2a mol·L-1HA水溶液中(HA为弱酸)。用NaOH调节溶液pH(忽略体积变化),得到c(HA)、c(A-)与溶液pH的变化关系如下图所示。下列说法错误的是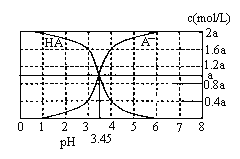
A.当pH=3时,溶液中c(A-)>c(Na+)
B.当c(A-)>c(HA),溶液一定呈碱性
C.当pH=3.45时,c(Na+)+c(H+)=c(HA)+c(OH-)
D.当pH=4时,溶液中:c(HA)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1
B
解析试题分析:A、当pH=3时,c(OH-)< c(H+)且溶液中存在电荷守恒:c(OH-)+c(A-)=c(Na+) +c(H+),所以溶液中c(A-)>c(Na+),正确;B、根据图像pH>3.45时,c(A-)>c(HA),溶液不一定呈碱性,错误;C、当pH=3.45时,c(A-)=c(HA)且c(OH-)+c(A-)=c(Na+) +c(H+),可得c(Na+)+c(H+)=c(HA)+c(OH-),正确;D、c(Na+)+c(H+)-c(OH-)=c(A-)="1.6a" mol·L-1,c(HA)="0.4a" mol·L-1,所以c(HA)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1,正确。
考点:考查图像分析、溶液中离子浓度关系。

常温下,向体积为10 mL、物质的量浓度均为0.1 mol/L的盐酸和醋酸的混合溶液中滴入0.1 mol/L NaOH溶液。下列说法错误的是( )
| A.加入NaOH溶液后,溶液一定满足: c(H+)+c(Na+)=c(OH-)+c(C1-)+c(CH3COO-) |
| B.加入10 mLNaOH溶液时,溶液满足(溶液体积变化忽略不计): c(CH3COO-)+c(CH3COOH)="0.05" mol/L |
| C.加入15 mLNaOH溶液时,呈酸性,溶液满足: c(Na+)>c(C1-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.加入足量NaOH溶液时,溶液中发生的中和反应的热化学方程式表示为: |
与CaC2一样,Mg3C2也是离子晶体,与水能发生复分解反应。关于Mg3C2的叙述正确的是
| A.与水反应有乙炔生成 | B.与水反应有Mg(OH)2生成 |
| C.有C-C键 | D.有C22-离子 |
室温下,有pH=3的盐酸、硫酸、醋酸(假设HAc的电离度为1%)三种相同体积的溶液。以下叙述错误的是
| A.测定其导电性能相同 |
| B.与足量的锌粉反应的起始速率相同 |
| C.与足量的锌粉反应产生氢气的体积比为1∶1∶100 |
| D.与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1∶2∶100 |
下列方程式中,属于水解反应的是
A.NH3 +H2O  NH3.H2O NH3.H2O |
B.HCO3— + H2O  H2CO3 + OH— H2CO3 + OH— |
C.H2O +H2O  H3O++OH— H3O++OH— |
D.HCO3— +H2O H3O+ +CO32— H3O+ +CO32— |
在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图6。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是
| A.a点:c(CO2-3)>c(HCO-3)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) |
| C.c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) |
| D.d点:c(H+)=2c(CO2-3)+c(HCO-3)+c(OH-) |
将体积为1mL,浓度为0.5mol/L的乙酸和体积为2mL,浓度为0.25mol/L的NaOH溶液混和,所得溶液中离子浓度由大到小的顺序是 ( )
| A.c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B.c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C.c(Na+)> c (OH-) > c(CH3COO-) >c(H+) |
| D.c(Na+)> c (OH-) > c(H+)> c(CH3COO-) |