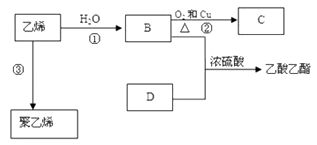
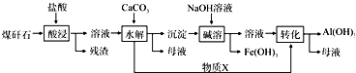
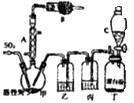
��Ŀ����
����Ŀ���� 2L �ݻ�������ܱ������ڣ�800��ʱ��Ӧ 2NO��g��+O2��g���T2NO2��g����ϵ�У�n��NO����ʱ��ı仯���±���
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����O2�ķ�Ӧ���ʱ�ʾ 0��2s �ڸ÷�Ӧ��ƽ����Ӧ���� v= �� ��������Ӧ��850���½��У���Ӧ2sʱ n��NO��=0.009mol�����Ҳ�����ʱ����ı䣬��÷�Ӧ���ȷ�Ӧ��
��2��ͼ�б�ʾNO2Ũ�ȱ仯��������������ĸ���� 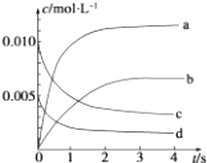
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����������ţ���
A.v��NO2��=2v��O2��
B.�����ڵ�ѹǿ���ֲ���
C.v����NO��=2v����O2��
D.�����������ܶȱ��ֲ���
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����������ţ���
A.��ʱ�����NO2
B.�ʵ������¶�
C.����O2��Ũ��
D.ѡ���Ч������
���𰸡�
��1��1.5��10��3mol?L��1?s��1����
��2��b
��3��BC
��4��C
���������⣺��1.��2s����NO��ʾ��ƽ����Ӧ����v��NO��= ![]() =
= ![]() =3.0��10��3molL��1s��1 �� ����֮�ȵ��ڻ�ѧ������֮�ȣ� ����v��O2��=
=3.0��10��3molL��1s��1 �� ����֮�ȵ��ڻ�ѧ������֮�ȣ� ����v��O2��= ![]() v��NO��=
v��NO��= ![]() ��3.0��10��3molL��1s��1=1.5��10��3molL��1s��1 ��
��3.0��10��3molL��1s��1=1.5��10��3molL��1s��1 ��
������Ӧ��850���½��У���Ӧ2sʱ n��NO��=0.009mol�����Ҳ�����ʱ����ı䣬��ԭƽ�����ʵ����࣬˵�������¶�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ��
���Դ��ǣ�1.5��10��3molL��1s��1���ţ�
��2.��NO2�Dz���淴Ӧ����Ũ������ƽ��ʱŨ��ΪNOŨ�ȵı仯����c��NO��= ![]() =0.0065mol/L������ͼ�б�ʾNO2�仯��������b��
=0.0065mol/L������ͼ�б�ʾNO2�仯��������b��
���Դ��ǣ�b��
��3.��A����ʾͬһ����Ӧ���ʣ�v��NO2����ʼ����Ϊv��O2����2��������˵���ﵽƽ�⣬��A����
B���淴Ӧ���У���Ӧ��������ܵ����ʵ����ڼ�С�����������ʵ������ֲ��䣬�����ڵ�ѹǿ���ֲ��䣬˵����Ӧ����ƽ�⣬��B��ȷ��
C����ͬ���ʱ�ʾ���ʣ�����ƽ��ʱ����������֮�ȵ��ڻ�ѧ������֮�ȣ�V�� ��NO��������O2��=2��1����V�� ��NO��=2v����O2������C��ȷ��
D�������������������䣬�����ݻ�Ϊ��ֵ�������ܶ���ʼ���ղ��䣬����˵���ﵽƽ�⣬��D����
���Դ��ǣ�BC��
��4.��2NO��g��+O2��g���T2NO2��g����H��0����Ӧ�����������С�ķ��ȷ�Ӧ����ȡ���д�ʩ��������ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ���
A����ʱ�����NO2���壬����������Ũ�ȣ�ƽ��������У�����Ӧ���ʼ�С����A����
B�������¶ȣ�ƽ�������ƶ�����B����
C������O2��Ũ�ȣ���ѧ��Ӧ���ʼӿ죬ƽ�������ƶ�����C��ȷ��
D��ѡ���Ч��������ѧ��Ӧ���ʼӿ죬ƽ�ⲻ�ƶ�����D����
���Դ��ǣ�C��
�����㾫�����������⣬������Ҫ�˽⻯ѧƽ��״̬���ʼ�����(��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��)����Ҫ���ջ�ѧƽ��״̬���ж�(״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y����)�����֪ʶ���Ǵ���Ĺؼ���

 â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�