题目内容
【题目】写出下列反应的化学方程式或离子方程式(是离子反应的,只写离子方程式).
(1)实验室制氯气: .
(2)氯气溶于水中: .
(3)用石英砂制粗硅: .
(4)用氯化铁溶液制作印刷电路板: .
(5)向偏铝酸钠溶液中通入过量的二氧化碳: .
【答案】
(1)MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)Cl2+H2O?H++Cl﹣+HClO
(3)SiO2+2C ![]() Si+2CO↑
Si+2CO↑
(4)2Fe3++Cu=2Fe2++Cu2+
(5)AlO ![]() +CO2+2H2O=Al(OH)3↓+HCO
+CO2+2H2O=Al(OH)3↓+HCO ![]()
【解析】解:(1)二氧化锰与浓盐酸在加热条件下生成氯化锰和氯气、水,离子方程式:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;所以答案是:MnO2+4H++2Cl﹣
Mn2++Cl2↑+2H2O;所以答案是:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;(2)氯气与水反应生成氯化氢和次氯酸,离子方程式:Cl2+H2OH++Cl﹣+HClO;所以答案是:Cl2+H2OH++Cl﹣+HClO;(3)二氧化硅与碳反应生成硅和一氧化碳,化学方程式:SiO2+2C
Mn2++Cl2↑+2H2O;(2)氯气与水反应生成氯化氢和次氯酸,离子方程式:Cl2+H2OH++Cl﹣+HClO;所以答案是:Cl2+H2OH++Cl﹣+HClO;(3)二氧化硅与碳反应生成硅和一氧化碳,化学方程式:SiO2+2C ![]() Si+2CO↑;所以答案是:SiO2+2C
Si+2CO↑;所以答案是:SiO2+2C ![]() Si+2CO↑;(4)氯化铁与铜反应生成氯化亚铁和氯化铜,离子方程式:2Fe3++Cu=2Fe2++Cu2+;所以答案是:2Fe3++Cu=2Fe2++Cu2+;(5)二者反应生成氢氧化铝和碳酸氢钠,离子方程式:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO
Si+2CO↑;(4)氯化铁与铜反应生成氯化亚铁和氯化铜,离子方程式:2Fe3++Cu=2Fe2++Cu2+;所以答案是:2Fe3++Cu=2Fe2++Cu2+;(5)二者反应生成氢氧化铝和碳酸氢钠,离子方程式:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO ![]() ; 所以答案是:AlO
; 所以答案是:AlO ![]() +CO2+2H2O=Al(OH)3↓+HCO
+CO2+2H2O=Al(OH)3↓+HCO ![]() .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用O2的反应速率表示 0~2s 内该反应的平均反应速率 v= . 若上述反应在850℃下进行,反应2s时 n(NO)=0.009mol,并且不再随时间而改变,则该反应是热反应.
(2)图中表示NO2浓度变化的曲线是(填字母). 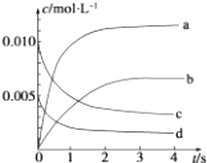
(3)能说明该反应已达到平衡状态的是(填序号).
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是(填序号).
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂.
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为 5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式___________________________________。增加压强,NO的转化率______________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______________ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是________________。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如图所示。由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_________(填“增大”、“不变”或“减小”)。