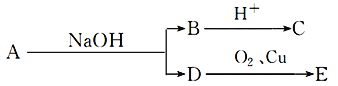
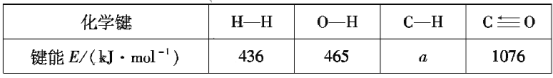
题目内容
【题目】下表为元素周期表的一部分。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | |||||||
(1)表中元素__
(2)表中元素⑦的原子结构示意图为__,在周期表中的位置为____
(3)表中元素⑥⑩的氢化物的稳定性顺序为__(填写化学式,下同)。
(4)表中元素⑩的最高价氧化物对应水化物的酸性:__。
(5)表中元素②和⑦的最高价氧化物对应水化物的碱性:__。
【答案】F K Br  第三周期IA族 HF>HCl HClO4>HBrO4 NaOH>LiOH
第三周期IA族 HF>HCl HClO4>HBrO4 NaOH>LiOH
【解析】
根据题给图表,可判断:①为H,②为Li,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为Mg,⑨为S,⑩为Cl,为K,为Al,为Br。可在此基础上解各小题。
(1)元素周期表中右上角(零族除外)元素非金属性最强,左下角金属性最强。所以,表中F的非金属性最强,K的金属性最强;Br的单质Br2室温下呈液态。
答案为:F;K;Br;
(2)表中元素⑦为Na,原子结构示意图为 ,在周期表中的位置为第三周期IA族。
,在周期表中的位置为第三周期IA族。
答案为: ;第三周期IA族;
;第三周期IA族;
(3)表中元素⑥、⑩分别为F、Cl,同主族元素,随核电荷数的增大,非金属性逐渐减弱,氢化物稳定性逐渐下降。所以氢化物的稳定性顺序为HF>HCl。
答案为:HF>HCl;
(4)表中元素⑩分别为Cl、Br,同主族元素,随核电荷数的增大,非金属性逐渐减弱,最高价氧化物对应水化物的酸性逐渐减弱。所以最高价氧化物对应水化物的酸性:HClO4>HBrO4。
答案为:HClO4>HBrO4;
(5)表中元素②和⑦分别为Li、Na,同主族元素,随核电荷数的增大,金属性逐渐增强,最高价氧化物对应水化物的碱性逐渐增强。所以最高价氧化物对应水化物的碱性:NaOH>LiOH。
答案为:NaOH>LiOH。

 名校课堂系列答案
名校课堂系列答案