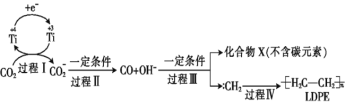
题目内容
【题目】关于下列各图的叙述,正确的是
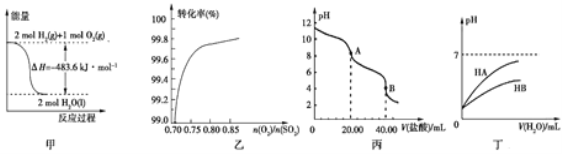
A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)在其他条件不变时,O2的转化率随
2SO3(g)在其他条件不变时,O2的转化率随![]() 的变化关系
的变化关系
C. 图丙表示用0.100 0 mol·L-1的盐酸滴定20.00 mL 0.100 0 mol·L-1Na2CO3溶液的曲线,从A点到B点反应的离子方程式为:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度溶液的pH:NaA<NaB
【答案】D
【解析】
A.图甲中2mol氢气完全燃烧生成液态水时放热483.6kJ,不是氢气的燃烧热,错误;B.该可逆反应中,增大氧气的量,氧气的转化率会不断减小,二氧化硫的转化率会不断上升,错误;C.A点的溶质为NaHCO3,故A点到B点反应的离子方程式为:![]() ,错误;D. 稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化HA溶液pH变化大,故酸性HA>HB,则同浓度的钠盐,水解程度:NaA<NaB,所以同浓度的NaA溶液的pH小于NaB溶液,正确。
,错误;D. 稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化HA溶液pH变化大,故酸性HA>HB,则同浓度的钠盐,水解程度:NaA<NaB,所以同浓度的NaA溶液的pH小于NaB溶液,正确。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目