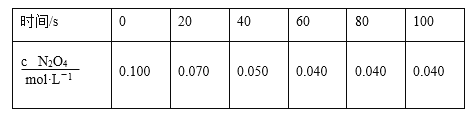
题目内容
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
根据上述信息计算:a=___、△H2=___。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___(用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___(填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2![]() 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。

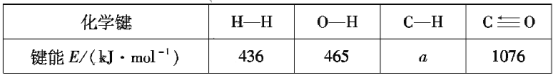
某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___(分压列计算式、不化简)。
【答案】415.1 -41.4kJ·mol-1 ![]() AC 温度低于T0时未达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小 20%
AC 温度低于T0时未达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小 20% 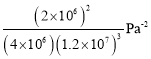
【解析】
(1)根据△H1=反应物键能-生成物键能计算a;根据盖斯定律计算△H2;
(2)根据K=![]() 计算;
计算;
(3)欲增大CH4转化为H2的平衡转化率要使平衡正向移动;
(4)温度低于T0时未达平衡,高于T0时反应达平衡,该反应是放热反应;根据压强比等于气体物质的量之比进行计算;
(1)反应CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1==4a kJ·mol-1+2×465 kJ·mol-1-(1076 kJ·mol-1+3×436 kJ·mol-1)= +206.4kJ·mol-1,解得a=415.1 kJ·mol-1;ⅢCH2(g)+2H2O(g)
CO(g)+3H2(g) △H1==4a kJ·mol-1+2×465 kJ·mol-1-(1076 kJ·mol-1+3×436 kJ·mol-1)= +206.4kJ·mol-1,解得a=415.1 kJ·mol-1;ⅢCH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1,I.CH4(g)+H2O(g)
CO2(g)+4H2(g) △H=+165.0kJ·mol-1,I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1,根据盖斯定律可知II=Ⅲ- I,所以△H2=△H-△H1=+165.0kJ·mol-1-206.4kJ·mol-1=-41.4kJ·mol-1,
CO(g)+3H2(g) △H1=+206.4kJ·mol-1,根据盖斯定律可知II=Ⅲ- I,所以△H2=△H-△H1=+165.0kJ·mol-1-206.4kJ·mol-1=-41.4kJ·mol-1,
故答案为:415.1;-41.4kJ·mol-1;
(2)由n(CO2)=dmol可知反应II生成的n(H2)= dmol,同时消耗的n(CO)=dmol,消耗的n(H2O)=dmol,则在反应I中生成的n(CO)=(b+d)mol,消耗的n(CH4)= (b+d)mol,消耗的n(H2O)= (b+d)mol,生成的n(H2)=(3b+3d)mol,则平衡时体系内:n(CH4)=(1-b-d)mol、n(H2O)=(4-b-2d)mol、n(CO)=bmol、n(H2)=(3b+4d)mol,容器体积为2L,故平衡常数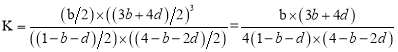 ,
,
故答案为:![]() ;
;
(3)A.适当增大反应物投料比武n(H2O):n(CH4),增大水的量促进甲烷转化成CO,促进CO转化成CO2,故A正确;
B.提高压强,反应I平衡左移,故B错误;
C.分离出CO2可使平衡右移,故C正确;
故答案为:AC;
(4)温度低于T0时未达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小;
设初始加入的N2为1 mol、H2为3 mol ,温度、体积一定时气体物质的量之比等于压强之比,气体物质的量减少4×10 % =0.4 mol;

其中p0=2×l07Pa ;
H2的转化率为0.6/3=20%;
平衡常数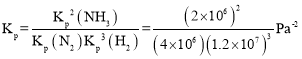
故答案为:温度低于T0时达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小;20%;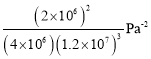 。
。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案【题目】为测定某抗酸药中碳酸钙固体的纯度(另一种成分为淀粉),称取12.5g此药片置于烧杯中,加入过量的稀盐酸,测得反应过程中烧杯和药品的总重量随时间的变化数据如下:
反应时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
烧杯和药品的总重/g | 310.0 | 306.8 | 305.9 | 305.7 | 305.6 | 305.6 | 305.6 |
计算:(1)共收集到标准状况下CO2的体积____________________;
(2)该样品中碳酸钙的质量分数________________________。
【题目】下表为元素周期表的一部分。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | |||||||
(1)表中元素__
(2)表中元素⑦的原子结构示意图为__,在周期表中的位置为____
(3)表中元素⑥⑩的氢化物的稳定性顺序为__(填写化学式,下同)。
(4)表中元素⑩的最高价氧化物对应水化物的酸性:__。
(5)表中元素②和⑦的最高价氧化物对应水化物的碱性:__。
【题目】某化学小组以环己醇![]() 制备环己烯.已知:
制备环己烯.已知:
密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环已醇加入试管A中,再加入1ml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环已烯粗品。
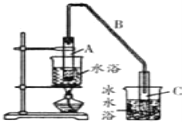
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_______。
②写出环已醇制备环已烯的化学反应方程式___________________________。
③试管C置于冰水浴中的目的是____________________________。
(2)环已烯粗品中含有环已醇和少量酸性杂质等需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在_______层(填上或下),分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是_____________________________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环已烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水