题目内容
【题目】已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00 mol·L-1、2.00 mol·L-1两种浓度,每次实验稀盐酸的用量为25.00 mL,锌有细颗粒与粗颗粒两种规格,用量为6.50 g。实验温度为298 K、308 K。
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
编号 | T/K | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和_______探究温度对该反应速率的影响; (Ⅲ)实验①和______探究锌规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①记录如下(换算成标况):
时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | span>100 |
氢气体积 (mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)=________(忽略溶液体积变化)。
②反应速率最大的时间段(如0s~10s......)为_______,可能原因是______。
③反应速率最小的时间段为________,可能原因是_________________________________。
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生H2气体总量的情况下,你认为他上述做法中可行的是____________(填相应字母);
A.氨水 B.CuCl2溶液 C.NaCl溶液 D.KNO3溶液
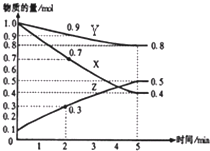
(4)另有某温度时,在2L容器中X、Y、Z物质的量随时间的变化关系曲线如下图所示,该反应的化学方程式为:_____________________________。
【答案】③ ④ 0.056 mol·L-1·s-1 40s~50s 反应放热 90s~100s 盐酸浓度降低 C 3X+Y![]() 2Z
2Z
【解析】
(1)根据实验的目的和影响化学反应速率的因素来设计实验,注意对照实验的设计关键是采用控制变量法来比较外界条件对反应速率的影响;
(2)①计算氢气的物质的量n(H2),再计算出溶液中氢离子浓度的改变,根据v=△c÷△t计算30s~40s范围内盐酸的平均反应速率;
②③根据相等时间段内,产生的氢气的体积越大,可以确定反应速率越快,据影响反应速率的因素来判断;
(3)根据浓度以及原电池原理的应用来确定化学反应速率的变化情况。据此解答。
(4)根据图像分析反应物和生成物,结合变化量之比是化学计量数之比解答。
(1)由实验目的可以知道,探究浓度、温度、接触面积对化学反应速率的影响,实验①②探究盐酸浓度对该反应速率的影响。要探究温度对该反应速率的影响,则固体的表面积以及盐酸的浓度应该是一样的,而两实验的温度应控制不同,所以实验①和③可达到实验目的。探究锌规格(粗、细)对该反应速率的影响,要求实验温度以及盐酸的浓度是相等的,表面积不同,所以实验①和④可达到实验目的。
(2)①在30s~40s范围内氢气的n(H2)=(224-67.2)×10-3L÷22.4L/mol=0.007mol,则溶液中的氢离子改变了0.007mol×2=0.014mol,则△c(H+)=0.014mol÷0.025L=0.56mol/L,所以在30s~40s范围内盐酸的平均反应速率v(HCl)=0.56mol/L÷10s=0.056mol/(L·s)。
②根据相等时间段内,产生的氢气的体积越大,可以确定反应速率越快,所以反应速率最大的时间段是40s~50s,可能原因是反应放热,温度高,反应速率快。
③根据相等时间段内,产生的氢气的体积越小,可以确定反应速率越慢,所以反应速率最小的时间段是90s100s,可能原因是反应进行过程中,盐酸浓度减小,反应速率变慢。
(3)A.加入氨水,盐酸被中和,能达到减慢速率的目的,但是影响了氢气的产量,故A不符合要求;
B.加入氯化铜,则金属锌会置换出金属铜,形成Cu、Zn、盐酸原电池,会加快反应速率,故B不符合要求;
C.在盐酸中加入NaCl溶液相当于将盐酸稀释,盐酸中氢离子浓度减小,所以速率减慢,但不影响氢气的产量,故C符合要求;
D.加入硝酸钾溶液后,锌与氢离子、硝酸根发生氧化还原反应生成一氧化氮,不再产生氢气,故D不符合要求。
答案选C。
(4)根据图像可知X和Y的物质的量减少,是反应物,Z是生成物,达到平衡时X减少1.0mol-0.4mol=0.6mol,Y减少1.0mol-0.8mol=0.2mol,Z增加了0.5mol-0.1mol=0.4mol,所以X、Y、Z物质的物质的量之比是3:1:2,因此方程式为3X+Y![]() 2Z。
2Z。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案