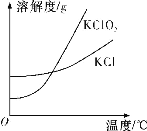
题目内容
【题目】位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族, D、E同周期。A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18。F是其所在周期中最活泼的金属元素。根据推断回答下列问题:
(1)A在周期表中的位置_____;写出A单质的电子式________。
(2)用“>”或“<”填空:
离子半径 | 非金属性 | 酸性 | 氢化物的稳定性 |
F+_D2— | A_B | D的最高价氧化物的水化物___E的最高价氧化物的水化物 | C的氢化物__E的氢化物 |
(3)—定条件,在水溶液中1molE-、![]() (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
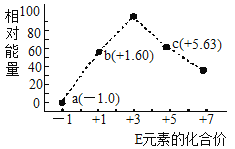
①c点对应的微粒是_______(填离子符号)。
②b→a+c反应的离子方程式为________,该反应是______反应(填“吸热”或“放热”)。
【答案】第二周期VA族 ![]() < < < >
< < < > ![]() 3C1O-=
3C1O-=![]() +2Cl- 放热
+2Cl- 放热
【解析】
A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18,应为同周期相邻元素,且分别位于周期表第VA、ⅥA、ⅦA元素,应分别为N、O、F元素,B、D同主族则D为S元素,D、E同周期则E为Cl元素,F是其所在周期中最活泼的金属元素由元素序数关系可以知道F为K元素。
(1)A为N元素,位于周期表第二周期VA族,A的单质为氮气,氮气的电子式为:![]() ,故本题答案为:第二周期VA族;
,故本题答案为:第二周期VA族;![]() ;
;
(2)K+、S2-具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径K+<S2-,同周期元素从左到右非金属性逐渐增强,则N<O,因非金属性Cl>S,则S的最高价氧化物的水化物小于Cl的最高价氧化物的水化物,非金属性F>Cl,元素的非金属性越强对应的氢化物越稳定,则HF>HCl,故本题答案为:<;<;<;>;
(3)①由图可知,c中氯元素为+5价,则d为ClO3-,故本题正确答案为:ClO3-;
②结合氯元素的化合价可以知道,b→a+c反应为3ClO-=ClO3-+2Cl-,生成1mol c时的能量变化为3×60kJ-63kJ-0=117kJ,反应物总能量大于生成物总能量,该反应放出117kJ热量,因此,本题正确答案为:3ClO-=ClO3-+2Cl-;放热。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案