题目内容
【题目】(乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)26H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为___。
(2)NO3-中氮原子轨道的杂化类型是___。
(3)与HNO2互为等电子体的一种阴离子的化学式为___。
(4)配合物[Mn(CH3OH)6]2+中配位原子是___。
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有___。
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为___。

【答案】1s22s22p63s23p63d4或[Ar]3d4 sp2 HCOO- O CH3COOH分子与H2O分子间可形成氢键 8
【解析】
(1)依据锰的原子的核外电子排布式,书写Mn3+基态核外电子排布式;
(2)依据NO3-中N的价层电子对数,判断N原子轨道的杂化类型;
(3)原子总数相等、价电子总数也相等的粒子互为等电子体;用替代法书写HNO2的等电子体;
(4)结合配合物的形成及结构判断配位原子;
(5)CH3COOH分子和H2O分子间形成氢键;
(6)根据Mg、Al合金的晶胞结构,分析晶体中每个铝原子周围距离最近的镁原子数目。
(1)锰为25号元素,核外电子排布式为1s22s22p63s23p63d54s2,则Mn3+基态核外电子排布式为1s22s22p63s23p63d4或[Ar]3d4,故答案为:1s22s22p63s23p63d4或[Ar]3d4;
(2)NO![]() 中N原子的价层电子对数=3+
中N原子的价层电子对数=3+![]() =3,氮原子采用sp2杂化,故答案为sp2;
=3,氮原子采用sp2杂化,故答案为sp2;
(3)与HNO2互为等电子体的一种阴离子为HCOO-,故答案为:HCOO-;
(4)配合物[Mn(CH3OH)6]2+中的中心原子为Mn,配体为CH3OH,提供孤对电子的原子是羟基中的O原子,则配位原子时O原子,故答案为:O;
(5)CH3COOH分子与H2O分子都是极性分子,另外CH3COOH分子与H2O分子间可形成氢键,使得CH3COOH能与H2O任意比混溶,故答案为:CH3COOH分子与H2O分子间可形成氢键;
(6)根据镁铝合金的晶胞结构可知,图中原子位于顶点或面心,其中镁原子顶点和其中2个面心,铝原子位于其中2个面心,每个铝原子周围距离最近的镁原子有8个,包括同一侧面的4个顶点和4个面心,距离均为晶胞面对角线长度的一半,故答案为8。

【题目】位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族, D、E同周期。A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18。F是其所在周期中最活泼的金属元素。根据推断回答下列问题:
(1)A在周期表中的位置_____;写出A单质的电子式________。
(2)用“>”或“<”填空:
离子半径 | 非金属性 | 酸性 | 氢化物的稳定性 |
F+_D2— | A_B | D的最高价氧化物的水化物___E的最高价氧化物的水化物 | C的氢化物__E的氢化物 |
(3)—定条件,在水溶液中1molE-、![]() (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
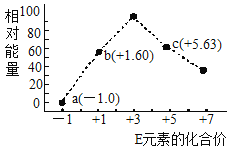
①c点对应的微粒是_______(填离子符号)。
②b→a+c反应的离子方程式为________,该反应是______反应(填“吸热”或“放热”)。
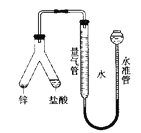
【题目】在“测定1mol气体体积”的实验中,我们通常选择的测量气体是氢气,反应是镁和稀硫酸反应。图中的A、B、C三部分能组成气体摩尔体积测定装置:
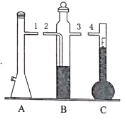
(1)C装置的名称是___________________。
(2)A、B、C装置接口的连续顺序是_________________。
(3)该装置正确连接后怎样做气密性检查?_________________。
(4)本实验中有两次针筒抽气,需要记录的是第____次抽出气体的体积。
(5)下表是某同学记录的实验数据:温度:25℃,气压:101.3kPa
实验次数 | 镁带质量(g) | 硫酸体积(mL) | C瓶读数(mL) | 抽出气体的体积(mL) |
1 | 0.115 | 10.0 | 124.8 | 7.0 |
2 | 0.110 | 10.0 | 120.7 | 6.2 |
计算两次实验1mol氢气的体积的平均值=____L(保留一位小数,镁的相对原子质量为24.3)。
(6)已知实验温度下,1mol氢气的体积的理论值为24.5L,实验误差=____%(保留三位有效数字)。
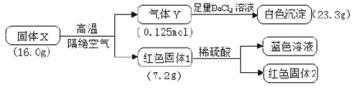
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
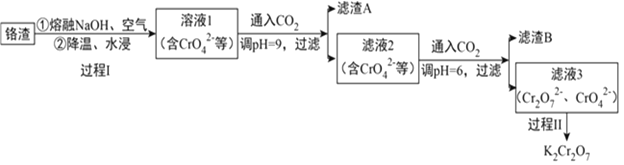
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是_______。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质可以循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
Cr2O72-+H2O K=4.0×1014滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。下表是不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 373 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:向滤液③中加入稀盐酸和KCl固体后,_____________,过滤,得到K2Cr2O7粗品。