题目内容
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
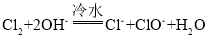 、
、![]()
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:
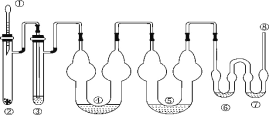
装置中盛装的药品如下:
①胶头滴管中装有 5 mL 浓盐酸;②微型具支试管中装有 1.5 g KMnO4;③微型具支试管中装有 2~3 mL 浓硫酸;④U 形反应管中装有 30% KOH 溶液;⑤U 形反应管中装有 2 mol·L-1 NaOH 溶液;⑥、⑦双 U 形反应管中分别装有 0.1 mol·L-1 KI-淀粉溶液和 KBr 溶液;⑧尾气出口用浸有 0.5 mol·L-1 Na2S2O3 溶液的棉花轻轻覆盖住
(1)检查整套装置气密性的方法是_________。
(2)为了使装置④⑤中的反应顺利完成,应该控制的反应条件分别为_______、_______。
(3)装置⑥⑦中能够观察到的实验现象分别是_________, _______。
(4)如果把装置⑥⑦中的试剂互换位置,则______(填“能”或“不能”)证明氧化性 Cl2>I2,理由是________。
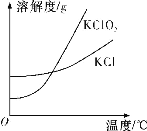
(5)已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置④所得溶液中提取氯酸钾晶体的实验操作是________。
(6)尾气处理时 Cl2 发生反应的离子方程式为_________。
(7)选择微型实验装置的优点有____________(任答两点)。
【答案】连接好实验装置,由⑧导管向⑦装置中加水,若能形成一段稳定的水柱,则装置的气密性良好 装置④放入348K热水浴中 装置⑤放入冰水浴中 装置⑥中溶液变蓝 装置⑦中溶液变成橙色 能 Cl2与KBr反应生成的Br2,氧化性Cl2>Br2,Cl2与挥发出来的Br2均可与KI反应,氧化性Br2>I2或Cl2>I2,均可证明氧化性Cl2>I2 蒸发浓缩、冷却结晶、过滤(洗涤、干燥) S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ 简化实验装置、节约成本;试剂用量少、能源消耗少;节省空间,缩短实验时间;减少污染等
【解析】
(1)连接好实验装置,可用液差法检查整套装置的气密性,具体方法为:连接好实验装置,由⑧导管向⑦装置中加水,若能形成一段稳定的水柱,则装置的气密性良好;
(2)④U形反应管中装有30%KOH溶液,用于制取氯酸钾,反应温度是348K,⑤U形反应管中装有2mol/LNaOH溶液用于制取次氯酸钠,反应条件是冷水中,所以装置④放入348K热水浴中,装置⑤放入冰水浴中,故答案为:装置④放入348K热水浴中;装置⑤放入冰水浴中;
(3)装置⑥中KI溶液与Cl2反应生成I2,使淀粉溶液变蓝,装置⑦中KBr溶液与Cl2反应生成Br2,溴水呈橙黄色,故答案为:装置⑥中溶液变蓝;装置⑦中溶液变成橙色;
(4)如果把装置⑥、⑦中的试剂互换位置,Cl2与KBr反应生成的Br2挥发出来会与KI反应生成I2,根据氧化性:Cl2>Br2>I2,仍然可得到氧化性:Cl2>I2,不影响实验结论。故答案为:能;Cl2与KBr反应生成的Br2,氧化性Cl2>Br2,Cl2与挥发出来的Br2均可与KI反应,氧化性Br2>I2或Cl2>I2,均可证明氧化性Cl2>I2;
(5)根据溶解度曲线,KClO3的溶解度随温度的变化较快,KCl的相对平缓,所以析出KClO3晶体可选择冷却结晶,使KCl析出少或不析出,最后过滤、洗涤、干燥得到KClO3晶体,故答案为:蒸发浓缩、冷却结晶、过滤;
(6)尾气处理时,Na2S2O3和Cl2发生氧化还原反应生成Na2SO4和NaCl,反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(7)微型实验装置可简化实验装置、节约成本;试剂用量少、能源消耗少;节省空间,缩短实验时间,减少污染等,故答案为:简化实验装置、节约成本;(或试剂用量少、能源消耗少;或节省空间,缩短实验时间,减少污染等)。

 阅读快车系列答案
阅读快车系列答案【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置___,基态E2+价电子的排布图为___,B元素能量最高的电子其轨道呈__形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为__。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为___,B、C、D简单离子的半径由大到小的顺序为___。
(4)写出C的核外有18个电子的氢化物的电子式___。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO=E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___。
(6)已知沸点:B2H4>A2H6,主要原因为________。
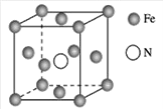
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___
【题目】位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族, D、E同周期。A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18。F是其所在周期中最活泼的金属元素。根据推断回答下列问题:
(1)A在周期表中的位置_____;写出A单质的电子式________。
(2)用“>”或“<”填空:
离子半径 | 非金属性 | 酸性 | 氢化物的稳定性 |
F+_D2— | A_B | D的最高价氧化物的水化物___E的最高价氧化物的水化物 | C的氢化物__E的氢化物 |
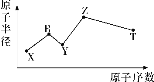
(3)—定条件,在水溶液中1molE-、![]() (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
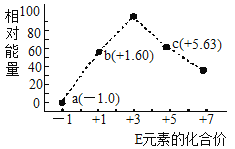
①c点对应的微粒是_______(填离子符号)。
②b→a+c反应的离子方程式为________,该反应是______反应(填“吸热”或“放热”)。