题目内容
17.用下列装置进行相应实验,能达到实验目的是( )| 选项 | A | B | C | D |
| 装置 |  | 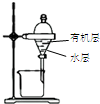 有机层水层 | 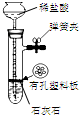 | 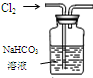 |
| 目的 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 分离CCl4萃取碘水后已分层的有机层和水层 | 制取少量CO2气体 | 除去Cl2中含有的少量HCl |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NH4Cl受热易分解;
B.CCl4的密度比水大;
C.石灰石为块状固体,能使反应随时停止;
D.氯气、HCl均与碳酸氢钠溶液反应.
解答 解:A.NH4Cl受热易分解,应采用冷却热NH4Cl饱和溶液制备NH4Cl晶体,故A错误;
B.CCl4的密度比水大,分层后在下层,与图中装置分层现象不符,故B错误;
C.石灰石为块状固体,能使反应随时停止,可制取二氧化碳,故C正确;
D.因氯气、HCl均与碳酸氢钠溶液反应,不能达到除杂的目的,应选用饱和食盐水,故D错误.
故选C.
点评 本题考查化学实验方案的评价,涉及除杂、晶体制备、气体的制取、混合物的分离等知识点,注重基础知识的考查,题目难度不大,选项A为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列说法错误的是( )
| A. | 乙烯可催熟水果 | |
| B. | SO2、CO2和NO2都可形成酸雨 | |
| C. | 盐析可提纯蛋白质并保持其生理活性 | |
| D. | 通过石油的裂解可获得乙烯、丙烯 |
8.短周期主族元素X、Y、Z、W在元素周期表中的位置关系如下图,下列推论合理的是( )
| X | Y |
| W | Z |
| A. | 若X、Y、Z、W中只有一种为金属元素,则W一定为铝元素 | |
| B. | 若W的核电荷数是Y的两倍,则W的氧化物可作半导体材料 | |
| C. | 若Z的核电荷数是Y的两倍,则X的氢化物水溶液显酸性 | |
| D. | 若Y、W的简单阴离子都能破坏水的电离,则Z的简单阴离子也一定能破坏水的电离 |
5.取底部沉积有NaCl固体的NaCl饱和溶液,滴加1-2滴浓盐酸(约12mol/L),即可观察到大量白色沉淀产生.根据上述事实及所学知识,下列说法正确的是( )
①析出的沉淀是NaCl
②推测饱和氯化钠溶液的浓度小于12mol/L
③得到的混合溶液中存在着溶解平衡
④加入浓盐酸后,NaCl的溶解速率小于NaCl的沉淀速率
⑤加热浓缩或降温也可以使NaCl析出.
①析出的沉淀是NaCl
②推测饱和氯化钠溶液的浓度小于12mol/L
③得到的混合溶液中存在着溶解平衡
④加入浓盐酸后,NaCl的溶解速率小于NaCl的沉淀速率
⑤加热浓缩或降温也可以使NaCl析出.
| A. | 全部 | B. | ①③④ | C. | ①③④⑤ | D. | ②③④⑤ |
2.下列说法正确的是( )
| A. | 取用金属钠时,多余的钠应放置于废液槽中,不应放回原试剂瓶中 | |
| B. | 用足量的稀硫酸可以除去Cu粉中混有的Fe2O3杂质 | |
| C. | 在托盘天平上称取2.0g氢氧化钠固体,然后在100mL容量瓶内溶解并稀释至刻度线,得到0.50mol•L-1氢氧化钠溶液 | |
| D. | 萃取过程中的振摇操作时,需将漏斗上口向下倾斜,下部支管口斜向上方 |
9.下列关于氨水的说法中,不正确的是( )
| A. | 氨水和液氨不同,氨水是混合物,液氨是纯净物 | |
| B. | 氨水中物质的量浓度最大的粒子是NH3•H2O(除水) | |
| C. | 氨水显弱碱性,故通常保存在金属容器中 | |
| D. | 在1 mol•L-1氨水中,NH3•H2O、NH${\;}_{4}^{+}$、NH3的物质的量浓度之和为1 mol•L-1 |
8.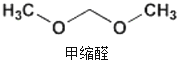 2015年央视3.15晚会曝光了山东省东营市、滨州市许多不法厂商,把一部分90号的汽油配上大量的石脑油、芳烃、甲缩醛等调和成“93号汽油”.查资料知,甲缩醛是一种无色易挥发可燃液体,主要用于生产杀虫剂、皮革和汽车上光剂等,是现行的车用汽油国家标准中不得添加的有害物质,它易造成汽车线路漏油,对动物有麻醉作用,也有一定毒性.下列对其说法中正确的是( )
2015年央视3.15晚会曝光了山东省东营市、滨州市许多不法厂商,把一部分90号的汽油配上大量的石脑油、芳烃、甲缩醛等调和成“93号汽油”.查资料知,甲缩醛是一种无色易挥发可燃液体,主要用于生产杀虫剂、皮革和汽车上光剂等,是现行的车用汽油国家标准中不得添加的有害物质,它易造成汽车线路漏油,对动物有麻醉作用,也有一定毒性.下列对其说法中正确的是( )
 2015年央视3.15晚会曝光了山东省东营市、滨州市许多不法厂商,把一部分90号的汽油配上大量的石脑油、芳烃、甲缩醛等调和成“93号汽油”.查资料知,甲缩醛是一种无色易挥发可燃液体,主要用于生产杀虫剂、皮革和汽车上光剂等,是现行的车用汽油国家标准中不得添加的有害物质,它易造成汽车线路漏油,对动物有麻醉作用,也有一定毒性.下列对其说法中正确的是( )
2015年央视3.15晚会曝光了山东省东营市、滨州市许多不法厂商,把一部分90号的汽油配上大量的石脑油、芳烃、甲缩醛等调和成“93号汽油”.查资料知,甲缩醛是一种无色易挥发可燃液体,主要用于生产杀虫剂、皮革和汽车上光剂等,是现行的车用汽油国家标准中不得添加的有害物质,它易造成汽车线路漏油,对动物有麻醉作用,也有一定毒性.下列对其说法中正确的是( )| A. | 甲缩醛和乙醛互为同系物 | |
| B. | 用甲醇和甲醛生产甲缩醛的反应为加成反应 | |
| C. | 等物质的量的甲缩醛和丙炔完全燃烧的耗氧量相同 | |
| D. | 用甲缩醛生产杀虫剂、皮革和汽车上光剂等,均是利用了它的毒性 |
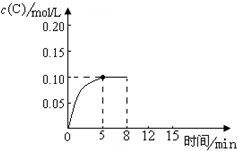 在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示
在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示