题目内容
12.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(1)关于该反应的下列说法中,正确的是C.(填字母)
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0

(2)容积一定,下列情况不能说明该反应一定达到平衡的是CD.
A.混合气体的平均平均相对分子质量不变
B.混合气体的压强不变
C.单位时间内生成3mol H-H键,同时生成2mol H-O键
D.混合气体中c (CO2):c (H2)=1:3
(3)温度降低,平衡常数K增大(填“增大”、“不变”或“减小”).
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH (g)的浓度随时间变化如图2所示.从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为0.225mol•L-1•min-1,CO2和H2的转化率比是1:1
(5)下列措施中能使(4)题中n(CH3OH)n(CO2)增大的有CE.(填字母)
A.升高温度 B.加入催化剂 C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大 E.再充入1molCO2和3molH2
(6)若在另一个密闭容器中充入1molCO2和3molH2,保持压强不变,并使初始体积与题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数< (4)题中的CO2的体积百分数.(“>”或“<”或“=”,下同)
分析 (1)由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,由方程式可知,该反应正反应是气体的物质的量减小的反应,故正反应为熵减过程;
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反应是气体体积减小的放热反应,依据化学平衡移动原理分析,正逆反应速率相同,各组分含量保持不变是破坏的标志,依据“变量不变”的原则分析选项;
(3)该反应正反应是放热反应,降低温度平衡向正反应移动,平衡常数增大;
(4)由图2可知,甲醇的浓度变化量为0.75mol/L,根据v=△c△t计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2),化学平衡三段式列式计算得到,转化率=消耗量起始量×100%;
(5)使n(CH3OH)n(CO2)增大,改变条件使平衡向正反应移动,但只增大二氧化碳的浓度会使该比值减小;
(6)恒压条件下,压强大于恒容条件下压强,对恒容容器相当于压强增大,平衡正向进行,比较该加入反应物条件下与(4)的压强比较,再比较容器中的CO2的体积百分数;
解答 解:(1)由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即△H<0,由方程式可知,该反应正反应是气体的物质的量减小的反应,故正反应为熵减过程,即△S<0,故选C;
故答案为:C;
(2)可逆反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),是气体体积减小的放热反应;
A.反应前后气体质量不变,但气体物质的量变化,混合气体的平均相对分子质量不变,能说明反应达到平衡状态,故A不符合;
B.反应前后气体物质的量不变,混合气体的压强不变说明反应达到平衡状态,故B不符合;
C.单位时间内生成3mol H-H键,反应逆向进行,同时生成2mol H-O键,水和甲醇中都含有H-O键,反应正向进行,不符合正逆反应速率相同,不能说明反应达到平衡状态,故C不合;
D.浓度之比和起始量,变化量有关,反应过程中变化量是混合气体中c (CO2):c (H2)=1:3,不能说明正逆反应速率相同,所以不能说明反应达到平衡状态,故D符合;
故答案为:CD;
(3)该反应正反应是放热反应,降低温度平衡向正反应移动,平衡常数增大;
故答案为:增大;
(4)由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=0.75mol/L10min=0.075mol/(L•min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L•min)=0.225mol/(L•min);此时依据化学平衡三段式列式计算为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量 1 3 0 0
变化量 0.75 2.25 0.75 0.75
平衡量 0.25 0.75 0.75 0.75
CO2和H2的转化率比是=0.751:2.253=1:1;
故答案为:0.225,1:1;
(5)使n(CH3OH)/n(CO2)增大,改变条件使平衡向正反应移动,但只增大二氧化碳的浓度会使该比值减小.
A.升高温度,平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误;
B.加入催化剂,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确;
D.充入He(g),反应混合物的浓度不变,变化不移动,n(CH3OH)/n(CO2)不变,故D错误;
E.再充入1mol CO2和3mol H2,等效为增大压强,平衡正反应移动,平衡时n(CH3OH)/n(CO2)增大,故E正确;故选CE;
故答案为:CE;
(6)恒容条件下,该反应前气体物质的量大于反应后气体物质的量,随着反应进行体系压强减小,不利于反应的正向进行,恒压条件下,压强大于恒容条件下压强,对恒容容器相当于压强增大,平衡正向进行,所以CO2的体积百分数小于(4)题中的CO2的体积百分数;
故答案为:<.
点评 本题考查平衡图象、化学平衡有关计算、反应速率、化学平衡的影响因素等,难度不大,注意基础知识的理解掌握,(5)中只增大二氧化碳的浓度会使该比值减小,可以借助平衡常数分析理解.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案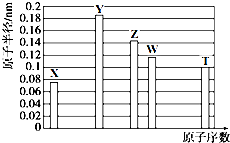
| A. | Z、T两种元素的离子半径相比,前者较大 | |
| B. | X、Y形成的两种化合物中,阴、阳离子物质的量之比分别为1:1和1:2 | |
| C. | X、W、T三种元素的气态氢化物中,稳定性最差的是W的氢化物,沸点最高的是T的氢化物 | |
| D. | Y、T两种元素的最高价氧化物对应的水化物均能溶解X和Z形成的常见化合物 |
| A. | 取用金属钠时,多余的钠应放置于废液槽中,不应放回原试剂瓶中 | |
| B. | 用足量的稀硫酸可以除去Cu粉中混有的Fe2O3杂质 | |
| C. | 在托盘天平上称取2.0g氢氧化钠固体,然后在100mL容量瓶内溶解并稀释至刻度线,得到0.50mol•L-1氢氧化钠溶液 | |
| D. | 萃取过程中的振摇操作时,需将漏斗上口向下倾斜,下部支管口斜向上方 |
| A. | 使用催化剂 | B. | 增大A物质的浓度 | C. | 增大B物质的浓度 | D. | 减少C物质的浓度 |
| A. | 实验表面实验室可用氨水洗涤银镜反应后的试管 | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| D. | 由资料信息科推知:加浓硝酸后生成的沉淀为AgCl |
| A. | 甘油可用于配制化妆品 | |
| B. | 福尔马林可用于食品、标本、木材等的防腐 | |
| C. | 食品饮料中的菠萝酯,只能从菠萝中提取,不能通过有机合成生产 | |
| D. | 在野外,被黑蚂蚁蜇伤后,涂抹烧碱液可以缓解因注入皮肤内的蚁酸带的疼痛 |
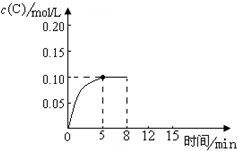 在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示
在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示


