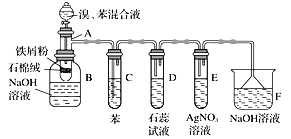
题目内容
【题目】兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
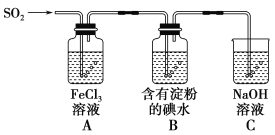
(1)SO2气体和Fe3+反应的氧化产物、还原产物分别是________、________
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4共热
(3)装置C的作用是__________________________________________________。
(4)装置B中反应的离子方程式_________________________________________________。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
【答案】SO42- Fe2+ BD 吸收多余的二氧化硫,防止污染空气 SO2 + I2 +2H2O = 4H+ +SO42- +2I- ① SO2也能使酸性高锰酸钾溶液褪色
【解析】
二氧化硫与碘、Fe3+发生氧化还原反应,方程式分别为SO2+I2+2H2O=H2SO4+2HI,2Fe3++SO2+2H2O =2Fe2++SO42-+4H+,由于二氧化硫具有毒性,所以用氢氧化钠溶液进行尾气处理。实验室制备气体要求操作简便安全,产物单一或易于提纯。
(1)根据氧化还原反应原理,二氧化硫中的硫元素化合价升高,失去电子,发生氧化反应,故SO2气体和Fe3+反应的氧化产物是SO42-,F e3+被还原为Fe2+,还原产物是Fe2+;
(2)A.Na2SO3具有还原性,硝酸具有氧化性,Na2SO3与HNO3反应生成Na2SO4、NO和水,不能制备SO2;
B.Na2SO3固体与浓硫酸,利用浓硫酸的酸性,强酸制弱酸Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,产物单一,符合题意;
C.固体硫在纯氧中燃烧,产生二氧化硫,但是纯氧量无法控制,不用于实验室制备SO2;
D.铜与浓H2SO4共热,实验室制取二氧化硫的常用反应,Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,产物单一,符合题意。
CuSO4+SO2↑+2H2O,产物单一,符合题意。
综上所述,采用BD进行SO2的实验室制备。
(3)二氧化硫具有毒性,氢氧化钠与SO2发生反应,保护环境。装置C的作用是吸收多余的二氧化硫,防止污染空气;
(4)装置B中反应的离子方程式SO2 + I2 +2H2O = 4H+ +SO42- +2I-;
(5)A中的溶液,理论上包括溶于水的部分二氧化硫,反应产生的亚铁离子和硫酸根离子,同时溶液显酸性。方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去,说明溶液中存在能与MnO4-反应的物质,亚铁离子和二氧化硫都能将KMnO4还原,故不能确定是否发生了反应;方案②往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色,说明产生了氢氧化亚铁,在空气中迅速被氧化为红褐色氢氧化铁沉淀,说明A中含有亚铁离子,能说明二氧化硫与Fe3+发生了氧化还原反应;方案③往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀,白色沉淀为硫酸钡,说明溶液中有SO42-,二氧化硫被氧化,能说明二氧化硫与Fe3+发生了氧化还原反应。综上所述,上述方案不合理的是方案①,原因是SO2也能使酸性高锰酸钾溶液褪色。