题目内容
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1=1.1×10-5,Ka2=1.3×10-8。下列叙述正确的是
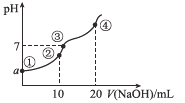
A.a近似等于3
B.点②处c(Na+)+2c(H+)+c(H2X)=2c(X2-)+c(HX-)+2c(OH-)
C.点③处为H2X和NaOH中和反应的滴定终点
D.点④处c(Na+)=2c(X2-)>c(OH-)>c(HX-)>c(H+)
【答案】A
【解析】
A.多元弱酸分步电离,以第一步为主,根据H2X![]() H++HX-,c(H+)=
H++HX-,c(H+)=![]() =
=![]() ≈10-3,a近似等于3,故A正确;
≈10-3,a近似等于3,故A正确;
B.点②处恰好生成NaHX,根据电荷守恒c(Na+)+c(H+)=2c(X2-)+c(HX-)+c(OH-)和质子守恒c(H+)+c(H2X)= c(X2-)+c(OH-)得:c(Na+)+2c(H+)+ c(H2X)=3 c(X2-)+ c(HX-)+2c(OH-),故B错误;
C. H2X和NaOH恰好反应生成Na2S,为中和反应的滴定终点,点④处为滴定终点,故C错误;
D.点④处恰好生成Na2X,c(Na+)>2c(X2-)>c(OH-)>c(HX-)>c(H+),故D错误;
答案:A

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目