题目内容
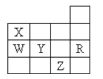
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C三种试剂,按图中的实验步骤进行操作:
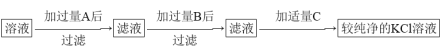
(1)B的化学式_________。
(2)加过量A的原因是________,有关反应的化学方程式为__________;____________。
(3)加过量B的原因是____________,有关反应的化学方程式为________;_______。
【答案】K2CO3 为了除尽Mg2+、![]() MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓ 为了除尽过量的Ba2+ Ba(OH)2+K2CO3=2KOH+BaCO3↓ BaCl2+K2CO3=BaCO3↓+2KCl
MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓ 为了除尽过量的Ba2+ Ba(OH)2+K2CO3=2KOH+BaCO3↓ BaCl2+K2CO3=BaCO3↓+2KCl
【解析】
KCl溶液中的杂质离子为Mg2+、SO![]() ,氢氧化钡可以同时和镁离子及硫酸根生成沉淀除去,此时杂质为钡离子和氢氧根,再加入碳酸钾可以将过量的钡离子除去,此时杂质为碳酸根和氢氧根,加入适量的盐酸可将碳酸根和氢氧根除去。
,氢氧化钡可以同时和镁离子及硫酸根生成沉淀除去,此时杂质为钡离子和氢氧根,再加入碳酸钾可以将过量的钡离子除去,此时杂质为碳酸根和氢氧根,加入适量的盐酸可将碳酸根和氢氧根除去。
(1)根据分析可知B应为K2CO3;
(2)加入过量的Ba(OH)2溶液可除尽Mg2+、![]() ,方程式为MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓、MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓;
,方程式为MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓、MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓;
(3)加入过量的碳酸钾溶液可以除尽过量的Ba2+;方程式为Ba(OH)2+K2CO3=2KOH+BaCO3↓、BaCl2+K2CO3=BaCO3↓+2KCl

【题目】卤块的主要成分是MgCl2,还含有少量Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按如下流程进行生产,以制备金属镁。

本流程操作条件下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 10.0 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
*Fe2+氧氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+后生成Fe(OH)3沉淀除去。 请回答以下问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施有 __________________________ (任写一条)。
(2)步骤②中NaClO的电子式为__________,加入NaClO溶液的目的是_________________________
(用离子方程式解释)。
(3)常温时,Mg(OH)2的Ksp=1.8×10-11。当溶液pH=10.0时,溶液中的c(Mg2+)=___________。
(4)若将步骤⑤中“稀盐酸”改为“加水、煮沸”的方式可以得到另一种沉淀物和一种无色无味的气体,请写出该反应的化学方程式__________________________________________。
(5)步骤⑥中涉及的操作是_____________________________,且⑥⑦操作均需在HCl气流中进行,其原因是_______________________________________。