题目内容
13.下列说法错误的是( )| A. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| B. | 主族元素的原子核外电子最后填入的能级是s能级或p能级 | |
| C. | BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 | |
| D. | 向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的氢氧化铜沉淀 |
分析 A、等电子体的结构相似;
B、主族元素原子的外围电子排布为ns1~2、ns2np1~6;
C、若主族的族序数+化合价的绝对值=8,则满足最外层为8电子结构;
D、向盛有硫酸铜溶液的试管里加入过量氨水,得到蓝色溶液.
解答 解:A、NH4+和CH4的原子数、价电子数都相等,属于等电子体,中心原子的价层电子对数均为4,因此空间构型都是正四面体,故A正确;
B、主族元素原子的外围电子排布为ns1~2、ns2np1~6,因此主族元素的原子核外电子最后填入的能级是s能级或p能级,故B正确;
C、H2O中H只满足2个电子的稳定结构,BF3中B所含电子数为3+3=6个,NCl3中N、Cl所含电子数为5+3=8、7+1=8,故C正确;
D、向盛有硫酸铜溶液的试管里加入过量氨水,得到蓝色溶液,该反应的离子方程式为:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O,因此无Cu(OH)2蓝色沉淀,故D错误;
故选D.
点评 本题考查主族元素电子排布特征、等电子体、元素及其化合物的性质等,难度不大,注意向盛有硫酸铜溶液的试管里加入氨水的量不同,反应机理不同.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
4.物质结构决定性质,深入研究物质的微观结构,有利于理解物质变化的本质.请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;C、N、O、F的第一电离能由大到小的顺序是F>N>O>C.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;C、N、O、F的第一电离能由大到小的顺序是F>N>O>C.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
1.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
(1)写出下列元素的名称:B氧,E氯;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
8.一定条件下,H2O2在水溶液中发生分解反应:2H2O2 $\frac{\underline{\;一定条件\;}}{\;}$2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
(1)H2O2的分解反应是氧化还原反应(填“是”或“不是”).
(2)该分解反应0─20min的平均反应速率v(H2O2)为0.02mol•L-1min-1.
(3)如果反应所用的H2O2溶液为100mL,则0─80min共产生O2Cg.
A.0.08 B.0.16 C.1.2 D.2.4.
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)该分解反应0─20min的平均反应速率v(H2O2)为0.02mol•L-1min-1.
(3)如果反应所用的H2O2溶液为100mL,则0─80min共产生O2Cg.
A.0.08 B.0.16 C.1.2 D.2.4.
18.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B 在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.回答下列问题:
(1)A在周期表中的位置是第一周期ⅠA族,
(2)由这些元素组成的物质,其组成和结构信息如表:
a的化学式为NaH;
b的化学式为Na2O2和Na2C2(写一种即可);
c的电子式为 .
.
(1)A在周期表中的位置是第一周期ⅠA族,
(2)由这些元素组成的物质,其组成和结构信息如表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
b的化学式为Na2O2和Na2C2(写一种即可);
c的电子式为
 .
.
5.在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8mol•L-1和5.4mol•L-1,在一定的条件下发生反应N2(g)+3H2(g)?2NH3(g).10min后测得N2的浓度是0.8mol•L-1,则在这10min内NH3的平均反应速率是( )
| A. | 0.1mol•L-1•min-1 | B. | 0.6mol•L-1•min-1 | ||
| C. | 0.3mol•L-1•min-1 | D. | 0.2mol•L-1•min-1 |
2.常温下,在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2.若忽略两溶液混合时的体积变化,则加入稀硫酸的体积与原BaCl2溶液的体积比是( )
| A. | 10:1 | B. | 1:10 | C. | 9:1 | D. | 1:9 |
3.香柠檬酚具有抗氧化功能,它的结构如图,下列说法正确的是( )
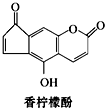

| A. | 它的分子式为C13H9O4 | |
| B. | 它与H2发生加成反应,1 mol最多可消耗7 mol H2 | |
| C. | 它与溴水发生反应,1 mol最多消耗3 mol Br2 | |
| D. | 它与NaOH溶液反应,1 mol最多消耗2 mol NaOH |