题目内容
12.下列离子在酸性溶液中能大量共存的是( )| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、K+、NO3-、SO42- | ||
| C. | Fe2+、K+、Na+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
分析 离子之间不反应生成气体、沉淀、弱电解质或发生氧化还原反应、双水解反应、络合反应且不与氢离子反应的能大量共存,据此分析解答.
解答 解:A.Fe3+、SCN-反应生成络合物而不能大量共存,故A错误;
B.这几种离子之间不反应且和氢离子也不反应,所以能大量共存,故B正确;
C.酸性条件下,Fe2+、NO3-发生氧化还原反应而不能大量共存,故C错误;
D.Fe2+、NH4+和OH-反应生成弱电解质,且氢离子和氢氧根离子反应,所以不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件即可解答,侧重考查复分解反应和氧化还原反应,易错选项是C.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| B. | 常温常压下,2.3gNa+中含有的电子数为NA | |
| C. | 标准状况下,11.2L臭氧含有的氧原子数为NA | |
| D. | 0.1 mol•L-1Na2CO3溶液中含有的钠离子数为0.2NA |
7.下列变化需克服相同类型作用力的是( )
| A. | 水和液氨的气化 | B. | 硅和C60的熔化 | ||
| C. | AlCl3和NaCl溶于水 | D. | 溴和汞的气化 |
17.下列各原子或离子的电子排布式错误的是( )
| A. | Si 1s22s22p2 | B. | O2- 1s22s22p6 | ||
| C. | Na+ 1s22s22p6 | D. | Al 1s22s22p63s23p1 |
4.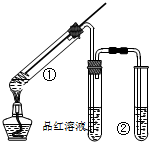 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )| A. | 浓硫酸既表现了强氧化性,又表现了酸性 | |
| B. | 品红溶液的作用是吸收SO2,防止空气污染 | |
| C. | 该实验体现环境保护和节约化学试剂的理念 | |
| D. | 装置②中盛放的试剂可能NaOH是溶液 |
1.以下实验方法肯定错误的是( )
| A. | 判断H2O2分解速率的大小,可以通过测定单位时间内H2O2分解放出的O2的体积 | |
| B. | 制摩尔盐时用酒精洗涤产品 | |
| C. | 用米汤直接检验食用盐中是否含有碘元素 | |
| D. | 以硝酸钠和氯化钾为原料可以制备硝酸钾 |
2.有机物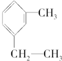 用系统命名法命名为( )
用系统命名法命名为( )
 用系统命名法命名为( )
用系统命名法命名为( )| A. | 间甲乙苯 | B. | 1,3-甲乙苯 | ||
| C. | 1-甲基-3-乙基苯 | D. | 1-甲基--5-乙基苯 |