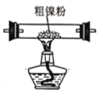
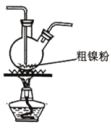
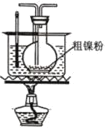
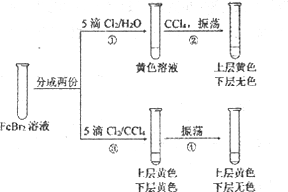
题目内容
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图,下列相关判断正确的是
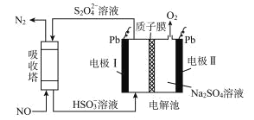
A.电极 I为阴极,电极反应式为 2H2O+2e-=2OH-+H2↑
B.电解池中质子从电极 I 向电极Ⅱ作定向移动
C.每处理 1 mol NO 电解池右侧质量减少 16 g
D.吸收塔中的反应为 2NO+2S2O42-+H2O=N2+4HSO3-
【答案】D
【解析】
A.HSO3-在电极I上转化为S2O42-,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,电极反应为:2HSO3-+2e-+2H+═S2O42-+2H2O,故A错误;
B.电极I为阴极,则电极Ⅱ为阳极,电解池中阳离子向阴极移动,所以电解池中H+通过质子膜向电极I处移动,故B错误;
C.电极Ⅱ为阳极,H2O在电极Ⅱ上被转化为O2,发生电极反应:2H2O-4e-═O2↑+4H+,NO转化为N2,每处理1 mol NO,则转移电子数为1mol×2=2mol,根据电子转移守恒,则产生O2的物质的量为2mol×![]() =0.5mol,同时有2mol H+从右侧迁移到左侧,所以电解池右侧质量减少为0.5mol×32g/mol+2mol×1g/mol =18g,故C错误;
=0.5mol,同时有2mol H+从右侧迁移到左侧,所以电解池右侧质量减少为0.5mol×32g/mol+2mol×1g/mol =18g,故C错误;
D.吸收塔中通入NO和S2O42-离子反应,生成N2和HSO3-,所以反应方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-,故D正确,
故选:D。

 名校课堂系列答案
名校课堂系列答案【题目】CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
I.制合成气
科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2 (g) (慢反应)
C(ads)+2H2 (g) (慢反应)
反应②:C(ads)+ CO2(g)![]() 2CO(g) (快反应)
2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
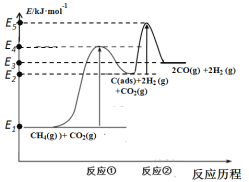
(1)CH4与CO2制备“合成气”的热化学方程式为_________。能量变化图中:E5+E1_________E4+E2(填“>”、“<”或“=”)。
II.脱水制醚
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g)![]() CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = 2.205+
CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = 2.205+![]() (Kc为化学平衡常数;T 为热力学温度,单位为K)。
(Kc为化学平衡常数;T 为热力学温度,单位为K)。
(2)反应达到平衡后,仅升高温度,k正增大的倍数_________ k逆增大的倍数(填“>”、“<”或“=”)。
(3)某温度下(该反应平衡常数Kc为200),在密闭容器中加入一定量 CH3OH,反应到某时刻测得各组分的物质的量如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆 (填“>”、 “<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_________(填标号)。
A <![]() B
B ![]() C >
C >![]() D 无法确定
D 无法确定
【题目】雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺是当前国内外研究的热点。
(1)天然气中含有的微量 H2S 会腐蚀管道和设备,可在 1200℃下进行脱硫处理,H2S 会被氧气氧化为SO2,并产生水蒸气。
化学键 | H-S | O=O | H-O | SO2 中共价键 |
键能/(kJmol-1) | 339 | 498 | 464 | 1083 |
请写出该反应的热化学方程式:______。
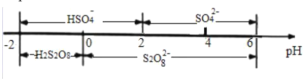
(2)利用 NaClO2/H2O2 酸性复合吸收剂可同时有效脱硫、脱硝,将 NO、SO2 氧化为硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液 pH 对脱硫脱硝的影响如图所示:
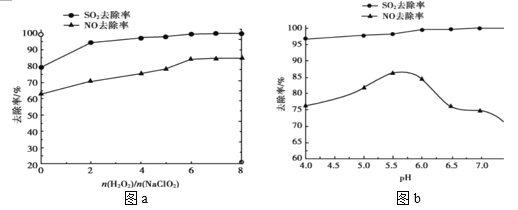
①从图 a 和图 b 中可知脱硫脱硝最佳 n(H2O2)/n(NaClO2)是_______、最佳 pH 是______。
②图 b 中 SO2 的去除率随 pH 的增大而增大,而 NO 的去除率在 pH>5.5 时反而减小,请解释 NO 去除率减小的可能原因是______。
(3)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为 2NO2(g)+O3(g)N2O5(g)+O2(g),不同温度下,在体积为 1L 的甲、乙两个恒容密闭容器中均充入 l mol O3 和 2 mol NO2,相关信息如图所示,请回答下列问题:

①0~15min 内乙容器中反应的平均速率:v(NO2) =______。(保留 2 位有效数字)
②下列措施能提高容器乙中 NO2 转化率的是________(填字母标号)
A.向容器中充入氦气,增大容器的压强
B.升高容器的温度
C.向容器中再充人一定量的 NO2
D.向容器中再充入 l mol O3 和 2 mol NO2
③甲容器的初始压强为 p0,计算该反应的平衡常数 Kp=______。(分压=总压×物质的量分数)
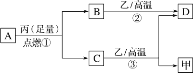
(4)过二硫酸钾(K2S2O8)可作为燃煤锅炉脱硝的氧化剂。实验室通过电解饱和 KHSO4 溶液制备 K2S2O8。电解装置如图所示:

①电极 B 为______极(“阳”或“阴”)。
②在常温下,电解液中的含硫微粒的主要存在形式与 pH 的关系如图所示,将电极 A 区域的 pH 控制在 0~2 之间进行电解,则电极 A 的电极反应方程式为______。