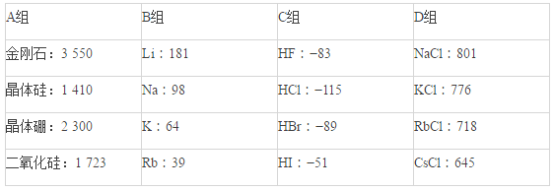
题目内容
【题目】雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺是当前国内外研究的热点。
(1)天然气中含有的微量 H2S 会腐蚀管道和设备,可在 1200℃下进行脱硫处理,H2S 会被氧气氧化为SO2,并产生水蒸气。
化学键 | H-S | O=O | H-O | SO2 中共价键 |
键能/(kJmol-1) | 339 | 498 | 464 | 1083 |
请写出该反应的热化学方程式:______。
(2)利用 NaClO2/H2O2 酸性复合吸收剂可同时有效脱硫、脱硝,将 NO、SO2 氧化为硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液 pH 对脱硫脱硝的影响如图所示:
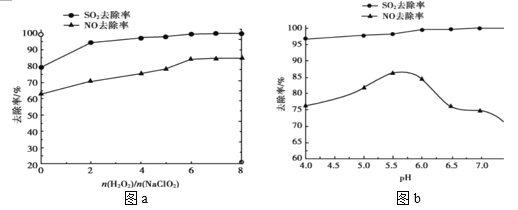
①从图 a 和图 b 中可知脱硫脱硝最佳 n(H2O2)/n(NaClO2)是_______、最佳 pH 是______。
②图 b 中 SO2 的去除率随 pH 的增大而增大,而 NO 的去除率在 pH>5.5 时反而减小,请解释 NO 去除率减小的可能原因是______。
(3)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为 2NO2(g)+O3(g)N2O5(g)+O2(g),不同温度下,在体积为 1L 的甲、乙两个恒容密闭容器中均充入 l mol O3 和 2 mol NO2,相关信息如图所示,请回答下列问题:

①0~15min 内乙容器中反应的平均速率:v(NO2) =______。(保留 2 位有效数字)
②下列措施能提高容器乙中 NO2 转化率的是________(填字母标号)
A.向容器中充入氦气,增大容器的压强
B.升高容器的温度
C.向容器中再充人一定量的 NO2
D.向容器中再充入 l mol O3 和 2 mol NO2
③甲容器的初始压强为 p0,计算该反应的平衡常数 Kp=______。(分压=总压×物质的量分数)
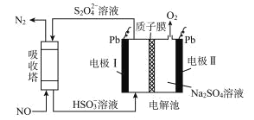
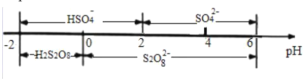
(4)过二硫酸钾(K2S2O8)可作为燃煤锅炉脱硝的氧化剂。实验室通过电解饱和 KHSO4 溶液制备 K2S2O8。电解装置如图所示:

①电极 B 为______极(“阳”或“阴”)。
②在常温下,电解液中的含硫微粒的主要存在形式与 pH 的关系如图所示,将电极 A 区域的 pH 控制在 0~2 之间进行电解,则电极 A 的电极反应方程式为______。
【答案】2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H= -1172 kJmol-1 6:1 5.5~6.0 之间的任意值均可 pH>5.5 以后,随着 pH 增大,NO 的还原性降低;或 H2O2 和 NaClO2 氧化性减弱,不能将 NO 氧化为硝酸 0.053 mol·L-1·min-1 D 1.5/p0 阴 2HSO4--2e-=2S2O82-+2H+
【解析】
(1)H2S与O2的反应的方程式为2H2S+3O2=2SO2+2H2O,△H =反应物键能-生成物键能=4×339 kJmol-1+3×498 kJmol-1-(2×1083 kJmol-1+4×464 kJmol-1)=-1172 kJmol-1,所以热化学反应方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H= -1172 kJmol-1;
(2)①从图a和图b中可知,![]() =6:1,pH在5.5~6.0时NO、SO2的去除率最高,故脱硫、脱硝的最佳条件是
=6:1,pH在5.5~6.0时NO、SO2的去除率最高,故脱硫、脱硝的最佳条件是![]() =6:1,pH在5.5~6.0之间;
=6:1,pH在5.5~6.0之间;
②图b中SO2的去除率随pH的增大而增大,pH>5.5后,随着pH增大,NO的还原性降低(或NaClO2和H2O2氧化性减弱),NO不能被氧化成硝酸,故NO的去除率在pH>5.5时反而减小;
(3)①据图可知15min时容器中c(N2O5)=0.4mol/L,容器体积为1L,则初始时c(O3)=1mol/L,c(NO2)=2mol/L,列三段式:
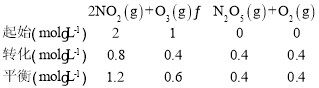
所以v(NO2)=![]() = 0.053 mol·L-1·min-1;
= 0.053 mol·L-1·min-1;
②提高容器乙中NO2转化率,即采取措施使反应2NO2(g)+O3(g)N2O5(g)+O2(g)向右进行的程度更大,温度甲<乙,平衡时正向程度甲>乙,表明正反应为放热反应,反应为气体分子数减少的反应,增大压强有利于反应正向进行,据此逐项分析,
A.恒容容器充入He,He不参与反应,充入He不改变气体各组分分压,不影响化学平衡,因此不能提高NO2转化率,故A不选;
B.反应为放热反应,升高温度不利于反应正向进行,不能提高NO2转化率,故B不选;
C.向容器中再充入一定量的NO2会使O3转化率升高,自身转化率降低,故C不选;
D.向容器中再充入lmol O3和2mo NO2,由于是按化学计量比充入,相当于对原平衡加压,则有利于反应正向进行,NO2平衡转化率增大,故D可选;
③初始气体总物质的量为1mol+2mol=3mol,平衡时甲容器中c(N2O5)=0.5mol/L,列三段式:
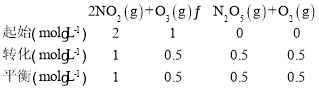
容器体积为1L,则平衡时气体总物质的量为1mol+0.5mol+0.5mol+0.5mol=2.5mol,则此时容器内压强为![]() ;则p(NO2)=
;则p(NO2)=![]() , p(O3)=p(N2O5)=p(O2)=
, p(O3)=p(N2O5)=p(O2)=![]() ,所以Kp=
,所以Kp=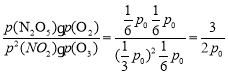 ;
;
(4)①K2S2O8中含有化合价为-1价的氧原子,所以KHSO
②据图可知pH在 0~2 之间时HSO4-并未电离,产物应为S2O82-,电极A为阴极得电子发生还原反应,所以电极方程式为2HSO4--2e-=2S2O82-+2H+。

 阅读快车系列答案
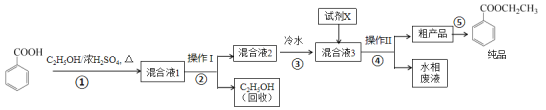
阅读快车系列答案【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为_________。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入 12.2 g纯化后的苯甲酸晶体,30 mL无水乙醇(约0.5 mol)和3 mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2 h。仪器A的作用是_________;仪器C中反应液应采用_________方式加热。
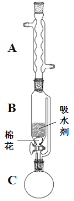
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为_________。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_________;操作II所用的玻璃仪器除了烧杯外还有_________。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有_____;加入试剂X为_____(填写化学式)。
(6)最终得到产物纯品12.0 g,实验产率为_________ %(保留三位有效数字)。