题目内容
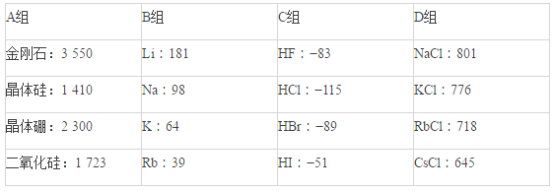
【题目】现有几组物质的熔点(℃)的数据:
据此回答下列问题:
(1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。
(2)B组晶体共同的物理性质是___________________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________。
(4)D组晶体可能具有的性质是_________________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。
【答案】原子 共价键 ①②③④ HF分子间能形成氢键,其熔化时需要消耗的能量更多(只要答出HF分子间能形成氢键即可) ②④ D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高
【解析】
(1)A组熔点最高,属于原子晶体,原子晶体的构成微粒为原子,微粒间作用力为共价键;
故答案为:原子;共价键;
(2)B组物质为金属,具有金属光泽、导电性、导热性、延展性,故答案为:①②③④;
(3)由于HF分子间存在氢键,导致HF的沸点比其它氢化物的沸点高,故答案为:HF分子间能形成氢键,其熔化时需要消耗的能量更多;
(4)D组物质为离子晶体,离子晶体具有硬而脆、水溶液能导电、固体不能导电而熔融状态能导电的性质,故答案为:②④;
(5)离子晶体中,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高;
故答案为:D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高。

【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向某溶液中先滴加稀硝酸,再滴加 | 该溶液中一定含有 |
B | 向 |
|
C | 向 |
|
D | 用 | 酸性: |
A.AB.BC.CD.D