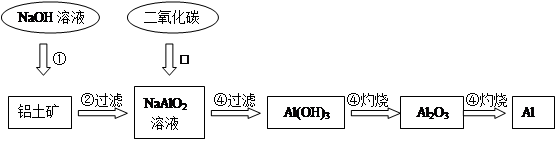
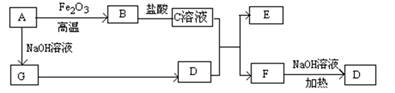
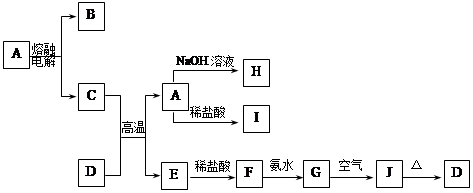题目内容
在实验室里,某同学取一小块金属钠做与水反应的实验。试完成下列问题:
切开的金属钠暴露在空气中,最先观察到的现象是 ,所发生反应的化学方程式是 。
(2)将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是:
① ,② 。
将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是 (填编号)。
| A.有气体生成 | B.钠融化成小球并在液面上游动 |
| C.溶液底部有银白色的金属钙生成 | D.溶液变浑浊 |
(4)根据上述实验过程中钠所发生的有关变化,试说明将金属钠保存在煤油中的目的是 。
(1)钠块表面由银白色变为暗灰色(或钠块表面变暗),4Na+O2 =2Na2O (每空1分,共2分)
(2)①钠与水反应放出热量 ②钠的熔点低, C(每空1分,共3分)
(3)0.02mol(2分)
(4)隔绝钠与空气中的氧气和水蒸气的接触(1分)
解析试题分析:(1)Na非常活泼,常温下能与空气中的氧气反应生成Na2O,钠块表面由银白色变为暗灰色,化学方程式为:4Na+O2 ==2Na2O。
(2)Na融化为小球,需要一定的能量,可推出钠与水反应放出热量;反应体系的温度不高,说明钠的熔点低;Na放入饱和石灰水中,Na与水反应,所以可观察到A、B现象;反应放热,饱和石灰水温度升高,但Ca(OH)2的溶解度随温度升高而减小,故Ca(OH)2固体析出,可观察到D中现象;因为Na与水反应,所以不可能置换出金属钙,故C项不可能观察到。
(3)H元素的化合价由+1价降低为0,所以对应关系为:H2~2e?,n(e?)=0.224L÷22.4L/mol×2=0.02mol。
(4)因为金属钠能与空气中的氧气和水蒸气反应,所以金属钠保存在煤油中的目的是隔绝钠与空气中的氧气和水蒸气的接触。
考点:本题考查实验现象的观察与分析、化学方程式的书写、电子转移数目的计算、物质的保存。

 名校课堂系列答案
名校课堂系列答案过氧化钠保存不当容易变质,生成Na2CO3。
(1)某过氧化钠样品已经部分变质,请你选择一种溶液 ,证明过氧化钠已经变质。
(2)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。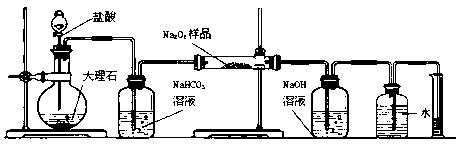
| A. | B. | C. | D.(E)(F) |
①写出装置B中发生反应的离子方程式:
②NaOH的作用是
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为 。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论 。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是
(填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈无色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。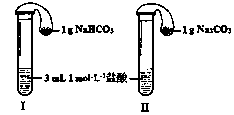
①两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是 。
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32- = CaCO3↓。 |
| 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 。
(一).对金属制品进行抗腐蚀处理,可延长其使用寿命。
以下为铝材表面处理的一种方法: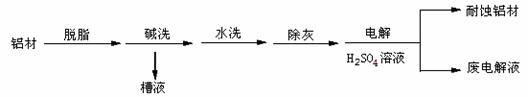
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出, 为将槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。 (填编号)
a.NH3 b.CO2 c.NaOH d.HNO3
(2)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,
阳极电极反应式为 。取少量废电解液,加入NaHCO3溶液,写出发生反应的离子方程式
(二).A—E五种元素中,除A、B外其他均为短周期元素它们的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
(1)在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和相应的固态化合物时,放出a KJ热量,此反应的热化学方程式是
(2)A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是
(3)向2mL 0.5mol/L的ACl3溶液中加入3mL 3mol/L KF溶液,
ACl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,
则下列说法正确的是(已知氧化性Fe3+>I2) (填字母)。
a.A3+不与I-发生反应
b.A3+与F-结合生成不与I-反应的物质
c.F-使I-的氧化性减弱
d.A3+被F-还原为A2+,使溶液中不再存在A3+
重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。已知MnO是碱性氧化物,Al粉可以将深色的Fe3+转化为浅色的Fe2+。
重晶石填料的生产工艺流程为:
(1)在该流程中,为加快“漂白”速度,采取的措施有 、
。
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
、 。
(3)二次漂白水洗过滤后,检验滤渣不含Fe2+离子的方法是
、 。
(4)二次漂白前,煅烧的主要目的是 。将煅烧后的固体磨成细粉,使用的是加有刚玉球的振动磨。这说明刚玉具有很高的 。
(5)工业生产中为了充分利用资源,将滤液经过处理得到化工原料Fe2O3。操作过程是:
①滤液中通入过量Cl2,其目的是 。
②再加入适量NaOH来调节溶液的pH ,其目的是 ,调节溶液的pH范围为 。
有关离子开始沉淀及完全沉淀时的pH如下:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(6)最后通过 、 得到氧化铁。
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某化学探究小组设计如下方案制备上述两种产品: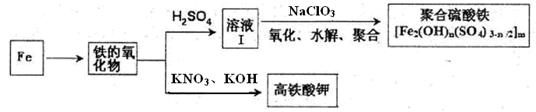
请回答下列问题:
(1)检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)
| A.稀硫酸 | B.稀硝酸 | C.KSCN溶液 | D.酸性高锰酸钾溶液 |
(3)Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平下列化学方程式:
□Fe2O3+□KNO3+□KOH——□ +□KNO2+□ 。
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol·L—1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I—=2Fe2++I2、I2+2S2O32—=2I—+S4O62—。
①写出滴定选用的指示剂 ,滴定终点观察到的现象 。
②溶液I中铁元素的总含量为 g·L—1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会 (填“偏高”、“偏低”、“不变”)。