题目内容
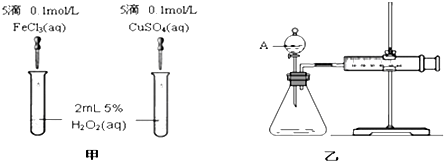
1.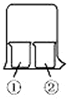 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白:(1)若①中放一片湿润的红色石蕊试纸,②装有浓氨水,可观察到的实验现象为试纸变蓝.
(2)若①装有AlCl3溶液,②装有浓氨水,可观察到的实验现象为烧杯①中出现白色沉淀,反应的离子方程式为Al3++3NH3•H3O=Al(OH)3↓+3NH4+.
(3)若①装有浓硝酸,②装有浓氨水,可观察到的实验现象为烧杯中出现白烟,反应的化学方程式为NH3+HNO3=NH4NO3.
(4)若①装有浓硝酸,②装有Na2SO3溶液,实验时有无色气体产生,该气体逐渐变为红棕色,用化学方程式表示无色气体变为红棕色的原因2NO+O2=2NO2,写出浓硝酸和Na2SO3溶液反应的离子方程式2NO3-+3SO32-+2H+=2NO↑+3SO42-+H2O.
分析 (1)浓氨水易挥发,挥发出的氨气易溶于水形成一水合氨属于弱碱,遇到酚酞试液变蓝色;
(2)浓氨水易挥发,挥发出的氨气易溶于水形成一水合氨属于弱碱,和氯化铝反应生成氢氧化铝白色沉淀;
(3)浓氨水和浓硝酸都具有挥发性,挥发出的硝酸分子和氨气会形成硝酸铵固体小颗粒,冒白烟;
(4)浓硝酸具有挥发性,挥发出的硝酸会氧化亚硫酸钠,硝酸钡还原为一氧化氮气体,无色气体变为红棕色是一氧化氮被空气中氧气氧化为二氧化氮气体,浓硝酸氧化亚硫酸钠为硫酸钠,浓硝酸被还以为二氧化氮;
解答 解:(1)浓氨水易挥发,挥发出的氨气易溶于水形成一水合氨属于弱碱,遇到酚酞试液变蓝色;
故答案为:试纸变蓝;
(2)浓氨水易挥发,挥发出的氨气易溶于水形成一水合氨属于弱碱,和氯化铝反应生成氢氧化铝白色沉淀,可观察到的实验现象烧杯①中出现白色沉淀,反应的离子方程式为:Al3++3NH3•H3O=Al(OH)3↓+3NH4+;
故答案为:烧杯①中出现白色沉淀,Al3++3NH3•H3O=Al(OH)3↓+3NH4+;
(3)浓氨水和浓硝酸都具有挥发性,挥发出的硝酸分子和氨气会形成硝酸铵固体小颗粒,冒白烟,可观察到的实验现象为烧杯中出现白烟,反应的化学方程式为:NH3+HNO3=NH4NO3;
故答案为:烧杯中出现白烟,NH3+HNO3=NH4NO3;
(4)浓硝酸具有挥发性,挥发出的硝酸会氧化亚硫酸钠,硝酸钡还原为一氧化氮气体,无色气体变为红棕色是一氧化氮被空气中氧气氧化为二氧化氮气体,反应的化学方程式为:2NO+O2=2NO2,浓硝酸氧化亚硫酸钠为硫酸钠,浓硝酸被还以为二氧化氮,反应的离子方程式为:2NO3-+3SO32-+2H+=2NO↑+3SO42-+H2O;
故答案为:2NO+O2=2NO2,2NO3-+3SO32-+2H+=2NO↑+3SO42-+H2O.
点评 本题考查了浓氨水、浓硝酸性质的分析应用,主要是挥发性的理解应用,掌握基础是关键,题目难度中等.

| A. | 与等体积pH=11的氨水混合后所得溶液pH小于7 | |
| B. | 与pH=3的CH3COOH溶液混合后所得溶液pH小于3 | |
| C. | 与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 | |
| D. | 与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
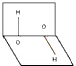
| A. | 分子的正、负电荷重心重合 | B. | 分子正、负电荷重心不重合 | ||
| C. | H2O2是极性分子 | D. | H2O2是非极性分子 |
| A. | SO2 | B. | H2 | C. | NH3 | D. | CO2 |
| A. | 11.2 LO2和O3组成的混合气体含有原子数为NA | |
| B. | 常温常压下,1.7 g NH3含有的电子数目为 NA | |
| C. | 0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA | |
| D. | 标准状况下,22.4 L NO2与足量的H2O充分反应后转移电子数为 NA |
①SF6 ②PCl5 ③PCl3 ④CS2 ⑤NO2 ⑥N2.
| A. | ①②④⑤ | B. | ②③⑤⑥ | C. | ③④⑥ | D. | ①③⑤ |
②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系c(NH4+)>c(SO42-)>c(H+)>c(OH-).
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10.混合溶液中由水电离出的c(H+)>0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
②该反应为吸热反应(选填吸热、放热).
③能判断该反应是否达到化学平衡状态的依据是BC.
(A)容器中压强不变
(B)混合气体中[CO]不变
(C)v正(H2)=v逆(H2O)
(D)C(CO2)=C(CO)
| A. | 含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-可共存 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2 CO(g)+O2(g)反应的△H=+566.0kJ/mol | |
| C. | 将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2 HClO | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有CO32- |