题目内容
6.下列热化学方程式中,正确的是( )| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ/mol,则 H2SO4 和 Ca(OH)2 反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol |
分析 A、燃烧热指的是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,注意生成的水应为液态;
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反;
C、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量;
D、依据热化学方程式的书写方法写出,注意物质聚集状态和反应的焓变.
解答 解:A、燃烧热指的是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,注意生成的水应为液态而不能为气态,所以甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ/mol,故A错误;
B、相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,1mol N2与3mol H2反应所生成的NH3
小于2mol,放出的热量小于38.6kJ,故B错误
C、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,其衡量标准是生成的水为1mol,故无论稀H2SO4和Ca(OH)2反应生成的水是几摩尔,其中和热恒为57.3KJ/mol,故C错误;
D、注意物质聚集状态和反应的焓变,在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol,故D正确;
故选D.
点评 本题考查了燃烧热、中和热以及热化学方程式的书写方法,掌握基础是关键,题目难度中等.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 11.2 LO2和O3组成的混合气体含有原子数为NA | |
| B. | 常温常压下,1.7 g NH3含有的电子数目为 NA | |
| C. | 0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA | |
| D. | 标准状况下,22.4 L NO2与足量的H2O充分反应后转移电子数为 NA |
17.下列实验中,不能观察到明显变化的是( )
| A. | 把一段打磨过的镁带放入少量冷水中 | |
| B. | 把Cl2通入FeCl2溶液中 | |
| C. | 把绿豆大的钾投入到水中 | |
| D. | 把溴水滴加到KI淀粉溶液中 |
14.Y元素最高正价与最低负价的绝对值之差是4,Y元素与M元素形成化合物M2Y,并在水中电离出电子层结构相同的离子,该化合物是( )
| A. | KCl | B. | Na2S | C. | Na2O | D. | K2S |
1.下列各组中,每种物质都既有离子键又有共价键的是( )
| A. | NaOH H2SO4 (NH4)2SO4 | B. | MgO Na2SO4 HNO3 | ||
| C. | Na2O2 KOH Na3PO4 | D. | HCl Al2O3 MgCl2 |
11.下列表述正确的是( )
| A. | 含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-可共存 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2 CO(g)+O2(g)反应的△H=+566.0kJ/mol | |
| C. | 将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2 HClO | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有CO32- |
18.下列化学用语正确的是( )
| A. | CH2CH2--乙烯的结构简式 | B. | 乙醇的结构简式--C2H6O | ||
| C. | 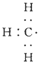 --甲基的电子式 --甲基的电子式 | D. | 四氯化碳的电子式为-- |
15.下列事实,不能用勒夏特列原理解释的是( )
| A. | 氯水中有下列平衡Cl2+H2O?HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g),平衡体系增大压强可使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO△H<0,升高温度可使平衡向逆反应方向移动 | |
| D. | 合成NH3反应,为提高NH3的产率,理论上应采取降低温度的措施 |
16.现有前20号的元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代:这种同位素的符号是146C(用元素符号表示)
元素Z的离子结构示意图为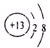 ,化合物WXY的电子式
,化合物WXY的电子式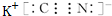 .
.
(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
| W | 灼烧其化合物时通过蓝色钴玻璃片观察火焰为紫色 |
元素Z的离子结构示意图为
 ,化合物WXY的电子式
,化合物WXY的电子式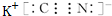 .
.(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.