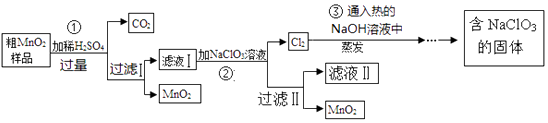
题目内容
【题目】发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径. 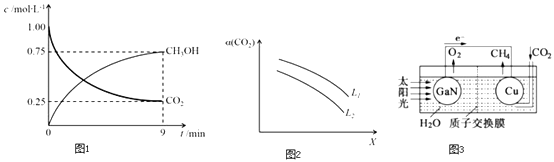
(1)将煤转化成水煤气的反应:C(s)+H2O(g)CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H(填“增大”、“减小”或“不变”),判断的理由是 .
(2)CO2制备甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 在体积为1L的密闭容器中,充入1mol CO2和3mol H2 , 测得CO2(g) 和CH3OH(g) 浓度随时间变化如图1所示.
①该反应化学平衡常数K的表达式是 .
②0~9min时间内,该反应的平均反应速率ν(H2)=
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是(填字母序号)kJ.
0<Q<29.5 b.29.5<Q<36.75 c.36.75<Q<49 d.49<Q<98
④在一定条件下,体系中CO2的平衡转化率(α)与L和 X的关系如图2所示,L和X 分别表示温度或压强.
X表示的物理量是. 判断L1与L2飞大小关系.
(3)科学家用氮化镓材料与铜组装如图3的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4 .
写出铜电极表面的电极反应式,为提高该人工光合系统的工作效率,可向装置中加入少量(选填“盐酸”或“硫酸”).
(4)利用CO2和NH3为原料也合成尿素,在合成塔中的主要反应可表示如下:
反应①:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=
反应②:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H2=+72.49kJmol﹣1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=﹣86.98kJmol﹣1;
则反应①的△H1= .
(5)现将amol铁和bmol铜的混合物与含有cmolHNO3的稀溶液充分反应,设还原产物为NO.下列结论不正确的是(填序号)
A.若剩余金属0.5amol,则氧化产物为一种或二种
B.若只有一种氧化产物,则3c=8a
C.若有二种氧化产物,被还原的硝酸物质的量为0.25cmol
D.若有三种氧化产物,被还原的硝酸物质的量为0.25cmol.
【答案】
(1)不变;加入催化剂后反应物和生成物的总能量不变
(2)![]() ;0.25mol/L?min;c
;0.25mol/L?min;c
(3)硫酸
(4)﹣159.47KJ/mol;﹣159.47KJ/mol
(5)BC
【解析】解:(1)将煤转化成水煤气的反应:C(s)+H2OCO2(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),催化剂改变反应速率不改变化学平衡,不改变反应焓变,此反应的△H不变,加入催化剂后反应物和生成物的总能量不变所以答案是:不变;加入催化剂后反应物和生成物的总能量不变;(2)①CO2(g)+3H2(g)CH3OH(g)+H2O(g),反应的平衡常数表达式为:K= ![]() ,
,
所以答案是: ![]() ;②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率=
;②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率= ![]() ,反应速率之比等于化学方程式计量数之比,V(H2)=3V(CH3OH(g)=3×
,反应速率之比等于化学方程式计量数之比,V(H2)=3V(CH3OH(g)=3× ![]() =0.25mol/Lmin,
=0.25mol/Lmin,
所以答案是:0.25mol/Lmin;③CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 反应达到平衡状态消耗二氧化碳物质的量浓度=1mol/L﹣0.25mol/L=0.75mol/L,物质的量为0.75mol,反应放出热量=49KJ/mol×0.75mol=36.75KJ,反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2 , 反应放热一定小于49KJ,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多,大于36.75KJ,则36.75<Q<49,
所以答案是:c;④CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 反应是气体体积减小的放热反应,
i.温度升高,平衡逆向进行,二氧化碳转化率减小,所以X为温度,L为压强,
所以答案是:温度;
ii.温度一定压强增大平衡正向进行二氧化碳转化率增大,所以L1>L2 ,
所以答案是:L1>L2;(3)由电池装置图可知,Cu上二氧化碳得电子生成甲烷,则Cu电极上的电极反应为:CO2+8e﹣+8H+=CH4+2H2O,可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸
所以答案是:CO2+8e﹣+8H+=CH4+2H2O;硫酸;(4)反应Ⅰ:2NH3(g)+CO2(g)NH2COONH4(s)△H1=akJmol﹣1
反应Ⅱ:NH2COONH4(s)CO(NH2)2(s)+H2O(g)△H2=+72.49kJmol﹣1
总反应Ⅲ:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)△H3=﹣86.98kJmol﹣1
依据盖斯定律计算反应Ⅰ+反应Ⅱ得到:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)△H3=akJmol﹣1+72.49kJmol﹣1=﹣86.98kJmol﹣1
a=﹣159.47akJmol﹣1 ,
所以答案是:﹣159.47KJ/mol;(5)A.若剩余金属0.5a mol,该金属可能为铁或铜,若为铁,则溶质为硝酸亚铁,若为铜,则氧化产物可能为硝酸亚铁和硝酸铜,故A正确;
B.若只有一种氧化产物,说明铁过量,铜没有参与反应,反应后溶质为硝酸亚铁,但是amol铁不一定完全反应,无法确定a与c的关系,故B错误;
C.若只有二种氧化产物,氧化产物可能为硝酸亚铁和硝酸铜或硝酸铜和硝酸铁,硝酸可能过量,稀硝酸不一定完全反应,则无法计算被还原的硝酸的量,故C错误;
D.若有三种氧化产物,氧化产物为硝酸铜、硝酸铁和硝酸亚铁,说明硝酸完全反应,根据反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可知,被还原的硝酸的物质的量为cmol× ![]() =0.25cmol,故D正确;
=0.25cmol,故D正确;
所以答案是:BC.
【考点精析】本题主要考查了反应热和焓变和化学平衡的计算的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高.
物质 | A | B | C | D |
起始投料/mol | 2 | 2 | 3 | 0 |
该反应的平衡常数表达式为K= . 升高温度,平衡常数将(填“增大”“减小”或“不变”).
【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是______________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式____________________________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在对水消毒时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有_____________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法
表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:
NaClO3+ HCl(浓)- ClO2↑+ Cl2↑+ H2O+ NaCl.
①配平方程式:______________。
②浓盐酸在反应中显示出来的性质是__________________(填序号)。
A.还原性 B.氧化性 C.酸性
③若上述反应中产生0.1molClO2,则转移的电子数为___________。